【指南发布】骨转换生化标志物临床应用指南
来源:CJOBMR 发布日期:2022-01-18 15:48:35浏览:41721次
指南发布
骨转换生化标志物临床应用指南
中图分类号:R589 文献标志码:A
中华医学会骨质疏松和骨矿盐疾病分会
中华骨质疏松和骨矿盐疾病杂志
2021年7月 第14卷 第4期 第321-336页
01 摘要 /Abstract
骨转换对于修复骨骼疲劳损伤和维持机体矿物质平衡至关重要,骨转换失衡是多种骨骼疾病的关键病理生理机制。骨转换生化标志物(bone turnover makers, BTMs)是骨转换过程中产生的代谢产物或酶类,本指南介绍BTMs的测量方法、正常值,及其在多种骨骼疾病的诊断与鉴别诊断、骨折风险预测、药物疗效评价等方面的应用。
02 关键词 /Key words
骨转换;骨转换生化标志物;骨质疏松症
03 正文
骨组织不断地进行骨塑建(Bone modeling)和骨重建(Bone remodeling),以维持骨骼生长和结构完整,这种破骨细胞(osteoclasts)不断吸收旧骨和成骨细胞(osteoblasts)不断形成新骨的自我更新过程,称为骨转换(bone turnover)。骨转换对于修复骨骼疲劳损伤和维持机体矿物质平衡至关重要。骨转换生化标志物或骨转换标志物(bone turnover markers,BTMs)是骨转换过程中产生的代谢产物或酶类,分为骨形成指标和骨吸收指标,前者反映成骨细胞活性及骨形成状态,后者代表破骨细胞活性及骨吸收水平。在骨吸收时,破骨细胞在骨骼不同部位去除少量骨质,形成吸收陷窝,骨吸收过程可持续3~6周。骨形成阶段,成骨细胞到达骨吸收陷窝,分泌富含胶原蛋白成分的类骨质以填充陷窝,随后类骨质矿化,完成骨形成,整个骨形成过程可持续4~5个月[1]。破骨细胞或成骨细胞活动时分泌的部分物质,会释放到骨微环境并进入血液循环,部分从尿液排出,这些物质的多少能反映破骨细胞或成骨细胞的活性,即骨吸收或骨形成水平,分别称为骨吸收指标或骨形成指标。骨吸收与骨形成呈时空偶联过程,受内分泌激素、机械应力和药物等因素的精密调控,骨转换失衡是多种骨骼疾病的关键病理生理机制。
检测BTMs浓度对于多种骨骼疾病的诊断与鉴别诊断、骨折风险预测、药物疗效评价等具有重要价值[2-4],中华医学会骨质疏松和骨矿盐疾病分会在2015年颁布了《骨代谢生化标志物临床应用指南》[5]。近年来,随着骨质疏松症和代谢性骨病的研究进展,特别是国内外BTMs的循证医学证据不断涌现[6-10],BTMs的临床应用日趋广泛。为此,中华医学会骨质疏松和骨矿盐疾病分会组织专家对2015年版指南进行修订,以期进一步规范和完善BTMs在我国的临床应用。
骨转换生化标志物的种类、测量方法及影响因素
BTMs反映骨形成和骨吸收水平及其活跃程度[11-13],分为骨形成标志物和骨吸收标志物。骨形成标志物主要有总碱性磷酸酶(alkaline pho-sphatase,ALP)、骨特异性碱性磷酸酶(bone-specific alkaline phosphatase,b-ALP)、1型原胶原氨基端前肽(procollagen type 1 N-terminal prope-ptide,P1NP)、1型原胶原羧基端前肽(procollagen type 1 C-terminal propeptide,P1CP)和骨钙素(osteocalcin,OC)。骨吸收标志物主要包括羟脯氨酸(hydroxyproline,HYP)、吡啶啉(pyridinolin,Pyr)、脱氧吡啶啉(deoxypyridinoline,DPD)、1型胶原交联羧基端肽(carboxy-terminal cross-linked telopeptide of type 1 collagen,CTX)、 1型胶原交联氨基端肽(amino-terminal cross-linked telopeptide of type 1 collagen,NTX)、抗酒石酸酸性磷酸酶5b(tartrate-resistant acid phosphatase 5b,TRAP 5b)等(表1)。

BTMs:骨转换生化标志物
此外,尚有多种重要细胞因子通过调控成骨或破骨细胞活性,参与调节骨转换,如骨保护素(osteoprotegerin, OPG)、核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL),即RANK配体、硬骨抑素(sclerostin)、白介素(interleukin)等,这些细胞因子均可视作骨转换调节因子[14],而非经典的骨转换生化标志物,不在本指南讨论之列。
骨形成标志物
总ALP和b-ALP:ALP是一种广泛存在的膜结合糖蛋白,人ALP有6种同工酶,主要来自肝脏、骨骼、肾脏、胎盘、生殖细胞、小肠等[15]。成人血液中总ALP约50%来源于肝脏,50%来源于骨骼。总ALP可能因肝脏、胆囊、胰腺等疾病而升高,这些疾病导致ALP不能特异性反映骨形成,但ALP作为常规生化检查,检测方便、价廉,仍为临床广泛使用。b-ALP由活跃的成骨细胞产生,在骨组织局部发挥催化水解磷酸单酯的作用,因此,b-ALP为特异性更好的骨形成标志物。需注意的是,b-ALP与肝脏来源的ALP结构相似,采用目前检测方法,两者约有15%~20%的交叉反应,所以,如果肝脏产生ALP过多,可能会引起b-ALP假性升高[1]。
OC:OC又称为骨γ-羧谷氨酸蛋白,是骨组织中含量最丰富的非胶原蛋白,主要由成骨细胞、成牙本质细胞和软骨细胞合成。成骨细胞分泌的OC在调节骨骼矿化、钙平衡和糖脂代谢中发挥重要作用[16]。OC由成骨细胞产生类骨质时释放到细胞外基质,其中一小部分进入血液循环。OC主要反映成骨活性,且比b-ALP更敏感。OC分为羧基化和未羧基化OC,前者以维生素K为辅因子,主要负责调控骨基质生成,后者主要调控糖脂代谢。由于OC半衰期短,在循环中可检测到OC全段或多种裂解片段,其中氨基端片段(N-Mid OC)更稳定,检测重复性较好[17]。
P1NP和P1CP:骨有机质中90%以上为1型胶原,是由1型原胶原在蛋白酶作用下剪切掉氨基端前肽(P1NP)和羧基端前肽(P1CP)而形成,随后1型胶原被组装在类骨质中,钙、磷、镁等矿物质沉积于其中,形成羟基磷灰石,而P1NP和P1CP则作为代谢产物进入血液和尿液中[14],能敏感地反映全身骨形成状态[18]。P1NP和P1CP均在肝脏代谢,由于P1NP反映骨形成的研究证据较P1CP丰富,P1NP是更佳的骨形成标志物[17]。
骨吸收标志物
HOP、Pry和DPD:骨组织中CTX或NTX通过吡啶啉或脱氧吡啶啉连接相邻两个1型原胶原分子。在胶原分子内部,羟脯氨酸通过氢键发挥稳定胶原纤维的作用。在骨吸收过程中,1型胶原降解,会释放出HOP、Pry和DPD,因此其是反映破骨细胞活性的骨吸收标志物。HOP主要在肝脏代谢,约10%的羟脯氨酸经尿液排出。由于HOP既来自骨吸收时1型胶原的降解,又来自皮肤、软骨等多种组织的分解代谢,因此HOP并非骨特异性标志物,临床上已较少使用[17]。Pry和DPD是稳定胶原之间链接的分子,骨吸收过程中,胶原分子链接被蛋白水解破坏,Pry和DPD释放入血,在尿液中可被检测到。绝大多数DPD存在于骨骼和牙本质,而Pry除骨骼外,还来源于韧带、软骨和血管等,因此,DPD较Pry能更特异地反映骨吸收水平[16]。
CTX或NTX:1型胶原分子间交联物能够稳定胶原结构,其羧基端片段CTX有α-CTX和β-CTX两种,β-CTX是α-CTX的异构体。在骨吸收过程中,CTX和NTX随着1型胶原分子的降解而释放入血,可经尿液排泄,故血液及尿液中的CTX和NTX浓度能够特异性反映骨吸收水平,由于β-CTX作为骨吸收标志物的研究更多,其为敏感而特异的骨吸收标志物[19]。
TRAP 5b:TRAP 5b是破骨细胞产生的酶类。骨吸收过程中,胶原降解产物被破骨细胞吞入,并与含有TRAP 5b的细胞囊泡融合,被TRAP 5b产生的氧化应激产物破坏,并和TRAP 5b一起分泌到细胞外。TRAP 5b主要在肝脏代谢,血清TRAP 5b水平能较好地反映破骨细胞的骨吸收活性[14]。
BTMs的测量方法
目前BTMs可采用多种方法进行检测,包括全自动生化仪检测、免疫放射法检测、电化学发光法检测、酶联免疫吸附法检测(enzyme linked immunosorbent assay, ELISA)、高效液相色谱法检测等,检测BTMs的标本及方法详见表1。
虽然血液和尿液标本均可用于BTMs检测,但为减少个体内变异,建议尽量选择血液作为检测标本。通常血液标本用于检测ALP、b-ALP、P1NP、P1CP、OC 和TRAP 5b等。尿液标本可用于检测Pyr和DPD。尿液和血液标本均可用于检测β-CTX和NTX。用尿液标本检测BTMs时需用尿肌酐(creatinine,Cr)进行校正,以BTMs/Cr 表示。
BTMs变化的影响因素
测量前影响因素:在进行BTMs结果解读时,须充分考虑多种因素的影响。测量前影响因素包括不可控因素和可控因素。不可控因素主要有年龄、性别、种族、疾病状态及近期骨折史等。可控因素包括昼夜节律、月经周期、季节、进食、运动及生活方式等。升高BTMs的因素包括绝经、骨折、制动、吸烟、药物(如芳香化酶抑制剂、抗惊厥药物、甲状旁腺素类似物等促骨形成药物)。妊娠期骨转换水平较妊娠前增加,尤以妊娠晚期与哺乳期升高更显著。冬季骨转换水平略高于其他季节。降低BTMs的因素包括高龄、酗酒、药物(如糖皮质激素、噻嗪类利尿剂、肝素、双膦酸盐及地舒单抗等抗骨吸收药物)。女性月经黄体期的骨吸收指标较其他时期降低,高强度运动可能增加骨形成,降低骨吸收[1]。以上因素中,进食、昼夜节律、年龄和性别是重要影响因素,为减少测量前影响因素,建议收集空腹状态、上午7:30-10:00的血液和尿液标本进行BTMs检测[1]。
P1NP是首选的骨形成标志物,受进食和昼夜节律影响小,可随机非空腹采血测量。β-CTX是首选的骨吸收标志物,受进食和昼夜节律的影响较大,需空腹清晨采血。b-ALP、P1NP、P1CP、TRACP 5b不经肾脏清除,适用于肾功能不全患者。
BTMs分析变异:最小有意义变化(the least significantchange, LSC),也称为临界差异或参考变化值,是指实验室连续测量结果之间的最小差异,用于判断患者真实变化值的意义[13]。简言之,由于正常检验测量存在误差与波动,患者BTMs的改变超过上述LSC才能视为有意义的变化。LSC计算方法如下:LSC=BTMs测定的“精确度误差”(CV)×2.77[20]。
骨转换生化指标的正常参考值
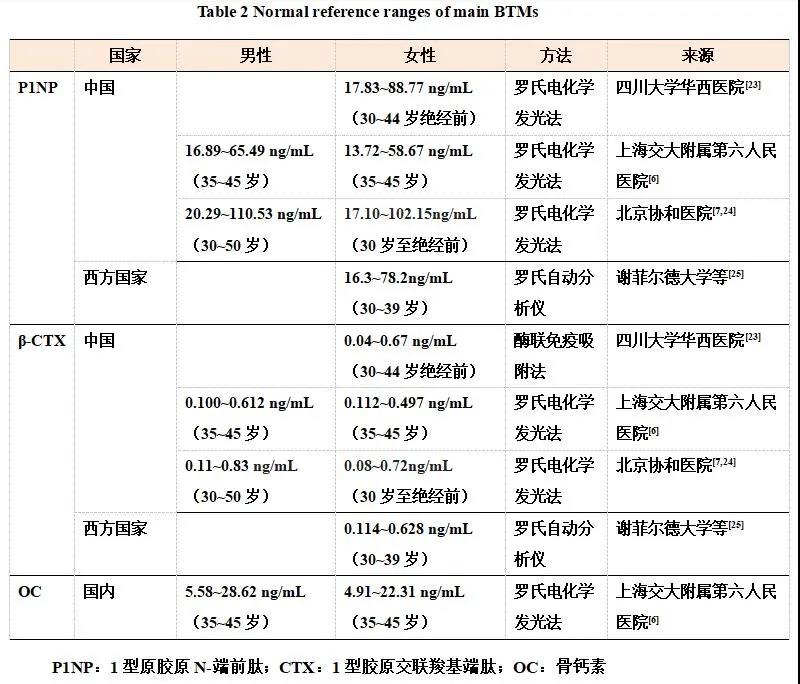
目前广泛应用的BTMs包括β-CTX、P1NP、OC和b-ALP,国内主要临床应用的是β-CTX、P1NP、OC、ALP。由于上述BTMs受种族、血清25羟维生素D(25 hydroxyvitamin D, 25OHD)水平及不同检测方法和质控等影响,目前国际上没有统一的BTMs正常参考范围,建议对同一种族、采用相同检测方法建立正常值参考范围[21]。目前比较一致的意见是将35~45岁年龄段的健康绝经前女性或男性的BTMs水平作为正常参考范围。关于BTMs变化规律及正常参考范围,我国学者经过一系列研究,获得了较为一致的结果(表2)。
2010年中南大学湘雅二医院使用ELISA方法,对694例20~82岁健康女性进行血清b-ALP、OC和CTX等指标的检测,显示20~29岁年龄段血清b-ALP、OC和CTX平均值显著高于30~39岁或40~49岁年龄段[22]。2012年四川大学华西医院对西部地区1 060例30岁及以上健康女性使用罗氏电化学发光法和ELISA方法检测血清P1NP和β-CTX等水平,显示30~44岁健康绝经前女性P1NP和β-CTX参考范围分别为17.83~88.77 ng/mL和0.04~0.67 ng/mL[23]。2013年上海交大交通大学附属第六人民医院纳入20~79岁健康上海居民2 799例,其中35~45岁健康受试者632例(男性226例,女性406例),采用罗氏电化学发光法,检测OC、P1NP和β-CTX水平,并观察其随年龄的变化规律及正常参考范围,显示女性BTMs在绝经后10年内升高,此后逐渐下降,但在男性中未观察到这种规律,男性在青壮年时期骨代谢较为活跃,其后BTMs维持在稳定水平[6]。35~45岁年龄段OC正常参考范围(95% CI)女性为4.91~22.31 ng/mL,男性为5.58~28.62 ng/mL;P1NP正常参考范围女性为13.72~58.67 ng/mL,男性为16.89~65.49 ng/mL;β-CTX正常参考范围女性为0.112~0.497 ng/mL,男性为0.100~0.612 ng/mL[6]。北京协和医院2014-2016年在北京、武汉、广州、上海和重庆开展了多中心平行横断面研究,纳入年龄15~110岁的健康受试者1 436例,采用罗氏电化学发光法检测P1NP 和β-CTX水平,结果显示P1NP 和β-CTX水平在15~19岁最高,随后逐渐下降并稳定,女性在绝经后至60岁BTMs明显升高,随后β-CTX和P1NP水平分别至65岁、70岁趋于下降[7,24],30岁至绝经前健康女性的P1NP和β-CTX水平(95% CI)分别为17.10~102.15 ng/mL和0.08~0.72 ng/mL,30~50 岁男性P1NP和β-CTX 水平(95% CI)分别是20.29~110.53 ng/mL和0.11~0.83 ng/mL[7,24]。
目前国内检测血清OC、P1NP和β-CTX主要使用电化学发光法,采用相同测量方法的研究结果表明我国健康人群P1NP和β-CTX水平无显著地区差异。西方国家BTMs正常参考范围多采用对法国、比利时、美国和英国健康人群的一项研究结果[25],纳入30~39岁健康女性共637例,同样使用罗氏电化学发光法检测BTMs水平,结果血清P1NP和β-CTX正常值参考范围(95% CI)分别为16.3~78.2 ng/mL和0.114~0.628ng/mL,该结果得到较多国外指南认可。国外研究显示BTMs的正常参考范围,与我国研究结果基本一致(表2)。
部分学者不建议采用“绝对”参考值 作为BTMs的参考范围,建议采用BTMs变化过程中的最低阈值(35~45岁年龄段范围)或治疗目标值来评估药物疗效或是否达到降低骨折风险的目标值[26]。
BTMs的临床应用
BTMs与骨折风险预测
绝经后骨质疏松症是由于雌激素缺乏,使骨转换加快,骨吸收大于骨形成,导致骨丢失,这种状态可在绝经后持续10年以上。骨丢失加快导致骨密度下降及骨微结构破坏,降低骨强度、增加骨折风险。因此,理论上BTMs水平升高可预测骨折风险。事实上,在大多数对女性的研究中,β-CTX、b-ALP、P1NP或OC单个指标升高与骨折风险相关,如血清β-CTX每增加一个标准差或最高四分位水平与最低四分位相比,椎体骨折风险上升1.4~2.2倍,非椎体骨折风险上升1.8~2.5倍,且在校正BMD后结果基本不变,表明BTMs对骨折风险具有独立预测作用[27]。如果将BTMs与BMD结合,可更好地预测骨折风险。瑞典EPIDOS研究表明, 绝经后女性10年骨折风险从高到低依次为:①血清β-CTX升高+脆性骨折史;②β-CTX升高+BMD的T值低于-2.5;③BMD的T值低于-2.5+脆性骨折史女性;④β-CTX升高或有脆性骨折史;⑤BMD的T值低于-2.5[28]。骨折风险评估在骨质疏松诊疗中具有重要意义, 但在BTMs与骨折关系研究中,由于涉及的BTMs种类繁多、统计方法各异、具有不同混杂因素等原因,导致研究结论尚不一致,且缺少充分的模型研究,限制了BTMs在骨折风险预测方面的应用。
BTMs与骨丢失和骨微结构损害
在骨骼生长发育过程中,骨转换率升高,达到峰值骨量后,骨转换率明显下降。此后无论男性还是女性,BTMs的水平与骨密度呈负相关,表明骨转换加速与增龄所致骨丢失密切关联[29]。围绝经期骨量由正常发展为骨量减少或骨质疏松的女性中,血清β-CTX和P1NP显著高于骨量仍正常的女性[30],具有高水平BTMs的中国女性发展为骨质疏松或骨量减少风险增加[31,32]。在骨微结构方面,男性70岁以后较高的BTMs水平与胫骨和桡骨皮质骨厚度和骨密度降低相关,处于BTMs最高四分位数的男性桡骨远端骨小梁密度、数量和厚度更低,且小梁分布更不均匀[33-35]。BTMs升高的女性有更高的皮质孔隙率、更薄的骨皮质和更高骨折率[36]。可见,BTMs增高和BMD下降、骨微结构受损相关。但需注意这是人群或队列研究,对于患者个体,当BTMs升高不是十分显著时,建议纵向观察不同时间点BTMs检测值的变化,以评估其与骨丢失的关系。
BTMs在骨质疏松症鉴别诊断中的意义
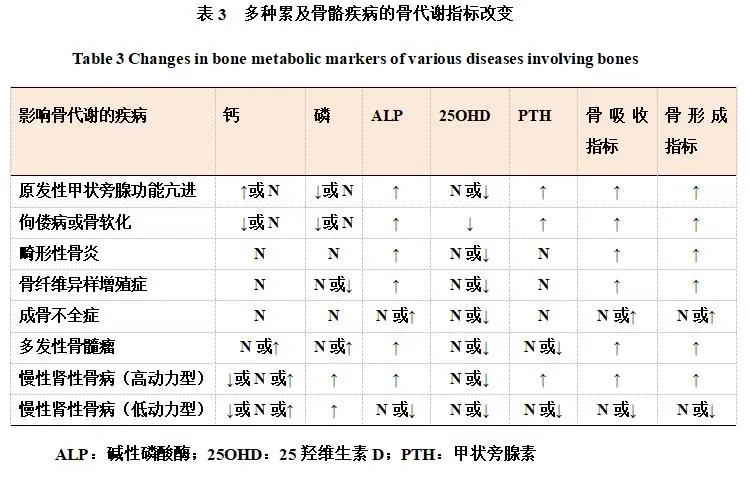
BTMs在骨质疏松症的鉴别诊断中具有重要意义。在原发性骨质疏松症患者中,除近期发生骨折,BTMs通常在正常范围或轻度升高,如患者BTMs显著升高,超过正常上限的两倍,常常提示患者可能存在继发性骨质疏松症或其他代谢性骨病、炎症性骨病或肿瘤性骨病等情况,要注意完善鉴别诊断。这里归纳多种疾病引起BTMs的变化(表3),包括原发性甲状旁腺功能亢进、佝偻病或骨软化症、畸形性骨炎、骨纤维异样增殖症、成骨不全症、甲状腺毒症、恶性肿瘤骨转移、多发性骨髓瘤、慢性肾性骨病等[1,5]。
除上述疾病会导致BTMs发生改变,多种药物也会影响BTMs水平[1],包括糖皮质激素[37]、芳香化酶抑制剂[1]、抗惊厥药物[38]、噻嗪类利尿剂[1]、肝素[39]、维生素K拮抗剂[1]等。骨质疏松症治疗药物,如多种骨吸收抑制剂或骨形成促进剂,也会明显影响BTMs水平,详见后文。
BTMs在骨质疏松症药物治疗中的意义
骨转换失衡导致骨吸收大于骨形成是骨质疏松症的关键病理机制,针对此机制,目前骨质疏松症治疗药物主要分为骨吸收抑制剂、骨形成促进剂和双重作用药物。本指南梳理BTMs在抗骨质疏松药物疗效评估中的意义,对于不同抗骨质疏松症治疗药物应重点关注哪些BTMs(图1),以及BTMs在药物治疗原发性骨质疏松症中的应用流程(图2)。BTMs的变化能够早期反映上述药物的疗效,建议在使用抗骨质疏松症药物前测量BTMs的基线水平,在药物治疗后3~6月,再次测量患者BTMs水平,了解BTMs的变化,判断患者对药物治疗的反应以及治疗的依从性,以进一步调整治疗方案,此后在药物治疗过程中,可每6个月到12个月测量BTMs水平,以了解药物治疗的有效性和患者的依从性。建议在抗骨质疏松药物治疗过程中,采用相同测量方法评估相同BTMs的动态改变。
骨吸收抑制剂:骨吸收抑制剂包括双膦酸盐类、地舒单抗、雌激素、选择性雌激素受体调节剂、降钙素等药物,能够明显抑制破骨细胞活性、减少骨丢失,增加骨密度、降低骨折风险[2]。在骨吸收抑制剂治疗骨质疏松症过程中,BTMs可早期反映药物疗效,并反映患者对药物治疗的依从性。
(1)双膦酸盐(bisphosphonate,BPs):BPs类药物包括阿仑膦酸钠、利噻膦酸钠、唑来膦酸、伊班膦酸钠等,是治疗骨质疏松症最常用的药物[40]。BPs通过抑制破骨细胞活性,减少骨吸收,增加骨密度,明显降低椎体、髋部和非椎骨骨折风险[41-44]。BTMs是双膦酸盐治疗原发性骨质疏松症的重要早期疗效评估指标。研究显示,BPs治疗8周就可引起β-CTX显著降低,而P1NP下降相对较晚、幅度较小,因此BPs治疗的净效应是减少骨吸收水平[9],且骨吸收指标下降幅度与BPs增加骨密度疗效呈正相关[45]。建议BTMs作为BPs治疗骨质疏松症的早期疗效指标。
由于BPs在骨骼中半衰期较长,且药物长期治疗可能引起下颌骨坏死及非典型性骨折风险升高,口服双膦酸盐治疗5年、静脉双膦酸盐治疗3年后,建议评估患者骨折风险,如其转为骨折低风险,建议停药,进入药物假期[46-47]。随着BPs停药时间延长,BTMs水平可能再次升高,骨密度逐渐下降,骨折风险再次升高[48],建议BTMs升高作为结束BPs药物假期、重启抗骨质疏松药物治疗的重要指标之一[49]。
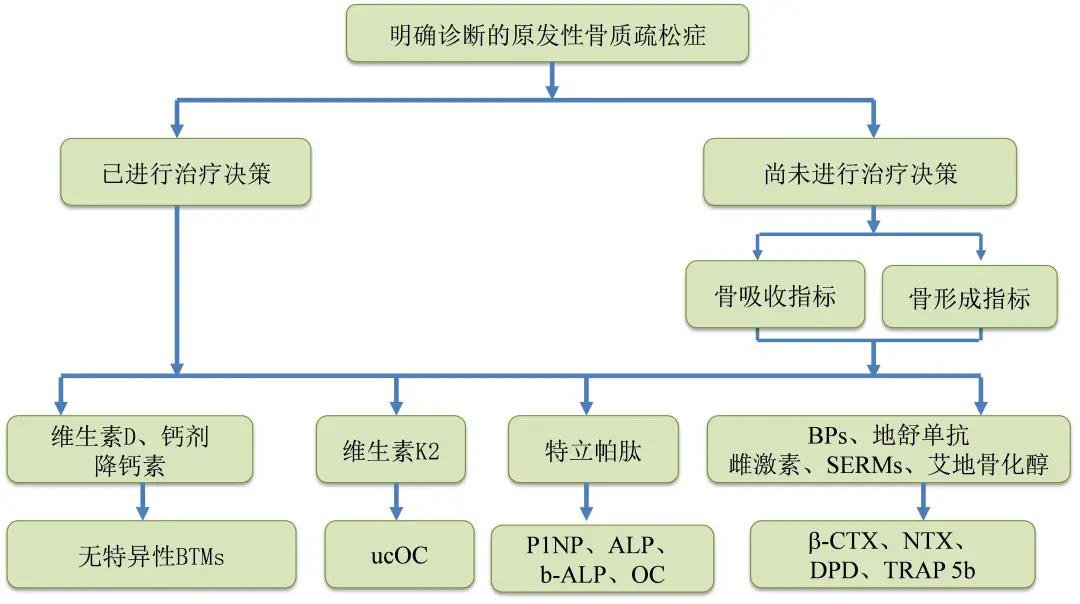
图1:评估不同抗骨质疏松药物疗效的主要BTMs
Fig 1Main BTMs for evaluating the effects of different anti-osteoporosis agents,BPs:双膦酸盐;SERMs:选择性雌激素受体调节剂;BTMs:骨转换生化标志物;ucOC:未羧基化骨钙素;P1NP:1型原胶原N-端前肽;b-ALP:骨源性碱性磷酸酶;OC:骨钙素;CTX:1型胶原交联羧基端肽;NTX:1型胶原交联氨基端肽;TRAP5b:抗酒石酸酸性磷酸酶5b;DPD:脱氧吡啶啉;ALP:碱性磷酸酶
(2)地舒单抗(denosumab):地舒单抗是完全人源化RANKL的单克隆抗体,能够特异性结合RANKL,减少破骨细胞的生成与活性,抑制骨吸收、增加骨密度、降低骨折风险[50]。研究显示地舒单抗注射后数天,骨吸收标志物β-CTX就明显下降,提示药物起效迅速,P1NP对治疗的反应相对较慢,在治疗3~6月后达到最低值[51]。地舒单抗治疗10年间,BTMs持续保持在较低水平,停止地舒单抗治疗后,BTMs将快速而显著地升高,骨吸收指标明显升高与患者停药后出现多发椎体骨折风险增加显著相关[52]。可见,BTMs不仅能够快速反映地舒单抗疗效,且停药后BTMs的迅速升高可反映椎体骨折风险的明显增加,预示此类该药不能轻易停药,一旦停药必须序贯其他抗骨质疏松药物治疗[53]。
(3)雌激素和选择性雌激素受体调节剂(selective estrogen receptor modulators, SERMs):雌激素能够与破骨细胞的雌激素受体结合,抑制骨吸收,减少骨丢失,被批准用于绝经后骨质疏松症的防治。选择性雌激素受体调节剂雷洛昔芬也可与雌激素受体结合,引起受体空间构象发生不同改变,在骨骼及心脏发挥类雌激素作用,在子宫及乳腺发挥拮抗雌激素作用,用于绝经后骨质疏松症的防治。雷洛昔芬治疗后BTMs明显降低,治疗12周β-CTX及P1NP分别下降39 %及32%,治疗48周,60%患者β-CTX下降超过LSC[54]。可见,尽管雌激素或SERMs治疗后BTMs下降幅度不如BPs及地舒单抗显著,但BTMs的变化仍可以反映此类药物的疗效。
骨形成促进剂:目前骨形成促进剂主要包括甲状旁腺素类似物特立帕肽(teriparatide,重组人甲状旁腺素1-34)、甲状旁腺素相关蛋白类似物阿巴洛肽(abaloparatide),目前我国上市的骨形成促进剂有特立帕肽。
(1)特立帕肽:在绝经后骨质疏松及部分继发性骨质疏松、男性骨质疏松的临床研究中,皮下注射特立帕肽20 μg/d后,数天内骨形成指标就显著升高,在3个月左右达到峰值,并在为期18~24个月的治疗中处于高水平,ACTIVE研究观察到其在治疗12个月时达到峰值[55]。特立帕肽治疗研究应用较多的骨形成指标是P1NP,其较基线水平升高幅度约50%~140%不等,通常认为其较基线升高超过10 ng/mL为治疗有反应。STRUCTURE研究显示既往接受双膦酸盐治疗的绝经后骨质疏松女性,转换为特立帕肽治疗1月使91%患者的P1NP升高超过10ng/mL[56]。多项研究提示治疗早期P1NP与基线的比值或较基线的变化百分率与18或24个月时腰椎BMD增加相关,提示P1NP可预测疗效[57-60],也有研究应用b-ALP或OC等骨形成指标评估药物疗效,变化类似。在中国绝经后骨质疏松症女性中进行的阳性药物对照研究中[61],观察到特立帕肽治疗24周时血清OC水平较基线升高139%,血清β-CTX水平或尿NTX也有升高,幅度30%~80%不等。在停用特立帕肽治疗后,可观察到BTMs水平迅速降低,伴随骨密度降低,提示应序贯使用骨吸收抑制剂,以维持疗效。
(2)阿巴洛肽:阿巴洛肽为甲状旁腺激素相关蛋白(parathyroid hormone-related protein,PTHrP)氨基端1-34片段类似物,与PTH氨基端1-22氨基酸序列相同,与PTH1受体选择性结合,促骨合成作用较特立帕肽更强[55,62]。在绝经后骨质疏松症女性中,阿巴洛肽80 μg/d治疗1周即使血清P1NP水平较基线显著升高,约1个月达到峰值,较基线升高约80%,至24周或18个月时较基线升高约30%~50%;β-CTX通常在阿巴洛肽治疗3个月明显升高,24周时较基线升高约20%~30%,18个月时恢复基线水平[55,62]。ACTIVE研究显示阿巴洛肽治疗3个月时血清P1NP变化率与治疗18月时BMD增幅相关[60]。骨组织形态计量学显示在阿巴洛肽 80 μg/d治疗1个月或3个月时BTMs变化能够很好反映组织形态学终点指标[63]。因此,BTMs可早期反映阿巴洛肽的疗效,且与BMD的增幅、骨微结构变化相关。
双重作用药物:Romosozumab为硬骨抑素的单克隆抗体,能够特异性抑制硬骨抑素活性,激活成骨细胞WNT信号通路,促进骨形成,并通过影响破骨细胞OPG-RANKL-RANK信号通路,抑制骨吸收,因此其具有独特的双重作用,显著增加患者骨密度。在绝经后骨质疏松女性中的研究表明,皮下注射Romosozumab 210 mg,1周后即观察到P1NP水平明显升高,FRAME研究显示P1NP在Romosozumab注射2周达到峰值,较基线升高约150%,随后逐渐下降,至9个月时恢复基线水平;而血清β-CTX在用药2周时显著降低至谷值,较基线水平降低约50%,并在治疗12个月期间一直维持在低水平[10]。在其他包括日本及韩国绝经后女性及男性骨质疏松症的临床研究中,BTMs水平呈类似改变[64-67]。研究显示,Romosozumab治疗12~24个月时P1NP仍持续高于基线水平,而血清β-CTX在治疗起始时显著降低,并在12~24个月的治疗中维持低水平[68]。因此,BTMs是早期反映Romosozumab疗效的重要指标,而且能够揭示其促进形成及抑制骨丢失的重要双重作用。
其他抗骨质疏松药物
(1)四烯甲萘醌(menatetrenone):为维生素K2类药物,能够增加羧基化骨钙素含量,可与羟磷灰石结合,促进骨骼矿化,改善骨微结构[69]。在四烯甲萘醌治疗过程中,血清未羧基化骨钙素水平明显降低,测量未羧基化骨钙素水平可以了解药物的疗效[70]。
(2)降钙素、钙剂与维生素D:钙剂与维生素D是治疗骨质疏松症的基础药物。降钙素属于骨吸收抑制剂,能够轻度抑制骨吸收、减轻骨痛。钙剂、维生素D制剂(包括普通维生素D、骨化三醇、阿法骨化醇、艾地骨化醇等)及降钙素治疗均可使BTMs轻度下降,尤其是骨吸收指标[71-72]。
(3)中成药:骨质疏松症的治疗药物尚包括部分中药,如人工虎骨粉、骨碎补总黄酮、淫羊藿苷等,其可一定程度改善骨质疏松症的临床症状,且对BTMs可能有一定影响[73],但中药对骨质疏松患者BTMs和BMD的作用,仍需大样本临床研究进一步证实。
在使用BTMs评估抗骨质疏松药物疗效中,建议采用LSC来帮助判断BTMs改变的临床意义。LSC等于BTMs测定的“精确度误差”(CV)×2.77[20]。在骨吸收抑制剂治疗过程中,BTMs下降幅度大于LSC或下降到健康绝经前女性参考值的一半以下,提示治疗有反应及患者依从性良好[20],如BTMs下降幅度小于LSC,提示临床医生要重新评估疾病诊断及患者的依从性,必要时要调整治疗策略。在骨形成促进剂治疗时,BTMs升高幅度大于LSC,提示治疗有反应及患者依从性良好,如BTMs升高幅度小于LSC,应重新评估疾病诊断及患者的依从性,必要时要调整治疗方案(图2)。
其他常用的骨代谢相关生化指标
甲状旁腺素(parathyroid hormone, PTH)
PTH是甲状旁腺主细胞合成和分泌的含84个氨基酸的多肽,其氨基端1-34片段具有生物学活性。PTH在维持机体钙磷平衡,调节骨转换中发挥重要作用[74-75]。PTH的靶器官主要是骨骼和肾脏,促使骨吸收增加、肾小管钙重吸收增加和磷重吸收减少,调节维生素D在肾脏的活化。
PTH在血循环中主要有四种形式:(1)PTH 1-84:有生物活性,血循环半衰期短,仅2~4 min,很快在肝肾裂解、代谢;(2)PTH1-34:有生物活性的PTH氨基端1-34片段,能迅速与靶细胞结合和分解,半衰期更短,不易测量;(3)PTH羧基端片段:包括PTH36-84、PTH44-84等,无生物活性,半衰期较长,1~2 h,是血液中PTH的主要成分;(4)PTH-M:中段PTH。PTH测量技术已发展三代,第一代为单一抗体的放射免疫法,检测PTH氨基端、中间段和羧基端等片段,由于其敏感性、准确性等不足,已被淘汰。由于采用的抗原表位不同,第二代技术可检测PTH1-84和PTH7-84片段,即临床上所指PTH或iPTH检测,第三代技术检测生物活性PTH1-84,目前PTH检测主要用第二代或第三代技术。
PTH水平受生理节律和进餐影响,推荐清晨空腹检测,正常参考值范围是15~65 pg/mL。临床上分析PTH浓度需结合血钙、尿钙、血磷和维生素D水平,并考虑年龄、肾功能等的影响。PTH水平增高常见于原发性甲状旁腺功能亢进症、继发性甲状旁腺功能亢进症和三发性甲状旁腺功能亢进症、假性甲状旁腺功能减退症等。PTH水平降低常见于甲状旁腺功能减退症和非甲状旁腺激素性高钙血症等。
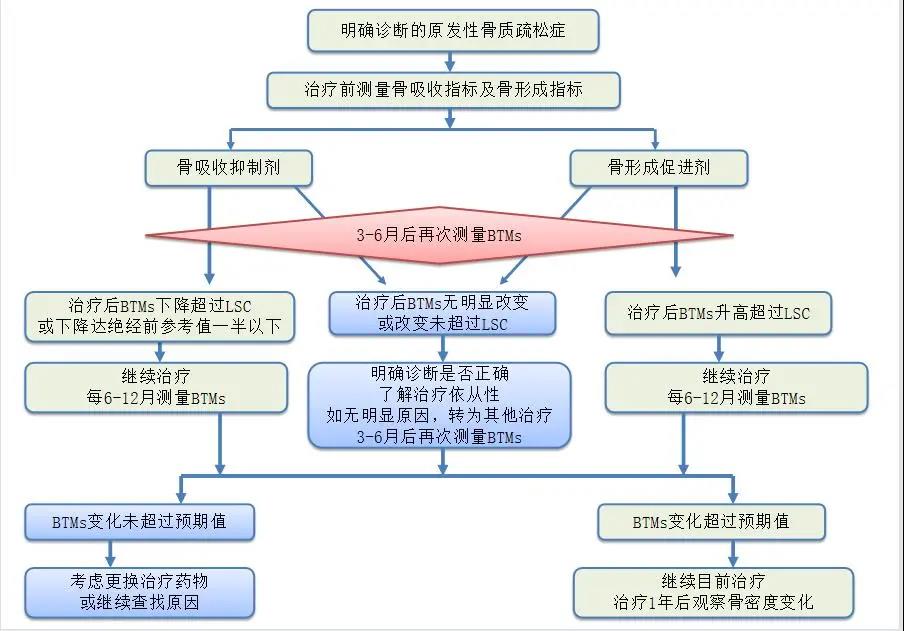
图2:BTMs在原发性骨质疏松症药物治疗中的应用流程
Fig 2Application process of BTMs in treatment of primary osteoporosis,BTMs:骨转换生化标志物;LSC:最小有意义变化值
维生素D
维生素D是一组具有不同生物活性甾体分子的总称,主要包括维生素D2和维生素D3,属类固醇激素。维生素D既是必须营养素,其代谢产物1,25(OH)2D又是内分泌激素。维生素D是骨骼和牙齿健康所必需,主要生理作用为调节钙磷代谢和骨基质矿化。维生素D促进小肠和肾脏近曲小管对钙、磷的吸收。维生素D对骨骼有两种作用:当血钙降低时,1,25(OH)2D与PTH协同作用,通过促进破骨细胞活性,增加骨溶解,维持血钙、磷的正常浓度。1,25(OH)2D可促进类骨质矿化,有利于骨矿盐沉积。除了调节骨骼和钙磷代谢外,维生素D还具有重要的骨外作用[76]。
25OHD是体内维生素D的主要储存形式,检测血清25OHD含量可了解维生素D的营养状况。具有生理活性的1,25(OH)2D血浓度仅为25OHD的千分之一,半衰期短,不易检测,常用放射免疫法测定,不推荐常规检测,仅应用于某些代谢性骨病的鉴别诊断。高效液相法是测定血清25OHD浓度的金标准,但耗时且费用高,难以广泛应用。目前最常用的25OHD检测方法是电化学发光法或免疫测定法。血清25OHD水平受日照、地理位置、季节等因素影响。多国指南建议25OHD浓度<20 ng/mL为维生素D缺乏;21~29 ng/mL为维生素D不足;≥30 ng/mL为维生素D充足[77]。多中心研究显示我国绝经后妇女91.2%存在维生素D不足,61.3%存在维生素D缺乏,25OHD水平在骨质疏松患者和高骨折风险患者中较低[77],因此,须重视维生素D营养状况的评估。
血钙
血清钙主要分为总钙和游离钙,是反映钙稳态的基本指标。血液中约50%钙与白蛋白及球蛋白结合,而未与蛋白质结合的钙称为游离钙。血清总钙受白蛋白影响,结合钙受血PH值影响,游离钙受甲状旁腺素、维生素D和降钙素等的精细调控,能更准确地反映钙代谢状态。成人血清总钙正常值范围2.2~2.7 mmol/L,血钙异常时,应考虑血清白蛋白、血液稀释或浓缩及其他因素的影响,并进行校正。校正公式:血清总钙校正值(mmol/L)=血钙测量值(mmol/L)+0.02×[40-血清白蛋白浓度(g/L)]。血游离钙可用游离钙测定仪检测,其正常水平为(1.18±0.05)mmol/L。
血钙增高见于甲状旁腺功能亢进症、维生素D中毒、甲状腺功能亢进症、多发性骨髓瘤、肿瘤骨转移、阿狄森病、结节病等。血钙降低见于甲状旁腺功能减退症、慢性肾功能不全、佝偻病、软骨病、吸收不良性疾病、大量输入柠檬酸盐抗凝等。
尿钙
临床上常用24 h尿钙排出量或尿钙/肌酐比值反映尿钙排泄水平。通常24 h尿钙排出量大于7.5 mmol(300 mg)为高尿钙症;低尿钙症的判断需考虑钙摄入量、尿钙排出量和血钙水平等因素,目前尚无公认标准。
引起尿钙增加的常见原因包括钙摄入过多、骨吸收加快等疾病(如甲状旁腺功能亢进症、库欣综合征、甲状腺功能亢进症、肾小管酸中毒、肿瘤骨转移或恶性骨肿瘤等)、长期制动、慢性代谢性酸中毒、维生素D过量或中毒、结节病等。引起尿钙减少的主要原因有维生素D缺乏、代谢性碱中毒、佝偻病、骨软化症等。
血磷
磷是人体必需营养素,也是多种组织和骨骼的重要组成成分。血磷主要指以磷酸盐形式存在的无机磷,约12%与蛋白结合,不能从肾小球滤过。磷在体内具有重要生理作用,与骨转换和骨骼矿化密切相关。血磷正常范围与年龄相关,成人:0.84~1.45 mmol/L(2.6~4.5 mg/dL),儿童较高,为1.29~2.26 mmol/L(4~7 mg/dL)[78]。
需注意的是,血磷受饮食影响。血磷浓度升高见于肾功能衰竭、甲状旁腺功能减退症、恶性肿瘤、肢端肥大症、骨骼快速丢失等。血磷减低见于甲状旁腺功能亢进症、维生素D缺乏、低血磷性佝偻病或骨软化症、范可尼综合征、肾小管性酸中毒或其他肾小管疾病等。
尿磷
临床上常用24h尿磷排出量、尿磷/肌酐比值反映尿磷排泄水平。尿磷排出量受多种因素影响,主要包括来源于肠道、骨骼和软组织的磷含量、肾小球磷滤过率和肾小管磷重吸收率等。理论不同年龄阶段的肾磷阈值为0.87~1.32 mmol/L[78]。若低磷血症患者的尿磷水平无减少,即提示不适当性尿磷排泄增加,多见于PTH分泌过多、成纤维细胞生长因子23(fibroblast growth factor-23,FGF-23)水平升高、范可尼综合征、低血磷性佝偻病或骨软化症等[5]。
问题和展望
近年来BTMs的研究和应用取得长足进展,为骨质疏松和多种骨骼疾病的诊断与鉴别诊断、骨折风险预测、药物疗效评估等提供了重要的临床参考,但仍存在以下问题:
(1)由于不同BTMs测量方法存在分析变异,同一测量方法也存在批内和批间变异,在分析BTMs结果时,需考虑检验变异的重要影响[13]。
(2)BTMs的测量受多因素影响,如昼夜节律、饮食和运动状态等。除骨代谢疾病外,炎症、肿瘤及慢性肝肾疾病等也可引起BTMs的异常变化[4]。因此,在分析BTMs结果时,要密切结合临床疾病进行解释。
(3)尽管有证据显示BTMs升高与骨量丢失、骨折风险增加有关,但任何单独一项或多项BTMs的变化,都不足以诊断骨质疏松症或其它代谢性骨病[2,79],须结合临床病史、体格检查和生化检查进行综合分析,才能获得正确临床诊断。此外,BTMs在骨折风险风层中的预测意义,值得探索。
(4)目前临床应用的BTMs缺乏骨组织部位的特异性,如无法区分骨膜、皮质骨和松质骨的骨转换情况,难以充分体现骨质量和骨脆性[80]。
关于BTMs的未来研究,尽管目前普遍认为骨转换过程是由成骨细胞和破骨细胞完成的,但骨组织细胞中成骨细胞占4%~6%,破骨细胞占1%~2%,而另外90%~95%为骨细胞,其可通过骨细胞性骨溶解来去除周边骨质,目前骨细胞对骨转换的影响亟待研究[1]。另外,骨细胞还可分泌许多因子[81-82],如FGF-23具有磷调节作用,硬骨抑素具有调节破骨细胞和成骨细胞的作用[83-84],这些骨细胞的代谢产物可能成为新的BTMs。此外,在骨质疏松症和不同骨骼疾病时,不同骨骼部位骨转换可能存在差异,研发特异性反映骨膜、皮质骨和松质骨等不同骨骼部位的BTMs,十分必要。如骨膜蛋白(periostin)主要定位于骨膜组织的基质细胞,有助于体现骨膜周围骨转换特征[85]。MicroRNA(miRNA)是一类由内源基因编码的非编码单链RNA分子,参与转录后基因表达调控,在调节成骨细胞和破骨细胞的分化和功能方面发挥重要作用[86],由于miRNA不被血中RNA酶降解,循环中miRNA可能成为新型候选BTMs。
总之,随着人们对疾病认识的逐渐提高和研究的深入,基因组学和蛋白质组学不断进步和临床应用,更多新型骨标志物将被发现,有望应用于临床,从而为骨质疏松症和多种骨骼疾病的诊断和治疗提供有益帮助。
参考文献:略
编写组名单
顾问:孟迅吾、徐苓、廖二元
组长:章振林
副组长:夏维波、李梅、程晓光、谢忠建、刘建民、徐又佳
执行组长:李梅
执行副组长:岳华、王鸥
•执笔者:章振林、夏维波、李梅、谢忠建、刘建民、徐又佳、侯建明、陈德才、袁凌青、岳华、王鸥、姜艳、盛志峰、张浩、王覃
•成员及单位(按作者姓氏笔画排序):
王以朋(北京协和医院)、王鸥(北京协和医院)、王覃(四川大学华西医院)、付勤(中国医科大学附属盛京医院)、邢小平(北京协和医院)、朱梅(天津医科大学总医院)、刘建民(上海交通大学医学院附属瑞金医院)、吕金捍(宁夏自治区人民医院)、严世贵(浙江大学医学院附属第二医院)、李梅(北京协和医院)、李玉坤(河北医科大学第三医院)、李蓬秋(四川省人民医院)、余卫(北京协和医院)、陈林(陆军军医大学大坪医院)、陈德才(四川大学华西医院)、林华(南京大学医学院附属鼓楼医院)、金小岚(西部战区总医院)、岳华(上海交通大学附属第六人民医院)、郑丽丽(郑州大学附属第一医院)、张浩(上海交通大学附属第六人民医院)、姜艳(北京协和医院)、侯建明(福建省立医院)、夏维波(北京协和医院)、袁凌青(中南大学湘雅二医院)、徐又佳(苏州大学附二院)、唐海(北京友谊医院)、盛志峰(中南大学湘雅二医院)、章振林(上海交通大学附属第六人民医院)、谢忠建(中南大学湘雅二医院)、程晓光(北京积水潭医院)、张克勤(上海同济大学附属同济医院)、霍亚南(江西省人民医院)
•基金项目:国家重点研发计划项目(2018YFA0800801);上海申康医院发展中心临床科技创新项目(SHDC12018120)
•通讯作者单位:1.李梅,夏维波:100730 北京,中国医学科学院北京协和医学院 北京协和医院 内分泌科,国家卫生健康委员会内分泌重点实验室;2.章振林:200233 上海,上海交通大学附属第六人民医院 骨质疏松和骨病专科,上海市骨疾病临床研究中心
• 通信作者邮箱:李梅,E-mail:limeilzh@sina.com;夏维波,E-mail:xiaweibo8301@163.com;章振林,E-mail:zhangzl@sjtu.edu.cn



第34期总第107期
编辑|何芳
审阅|李梅 孙静
监制|夏维波