CSOBMR指南发布:甲状旁腺功能减退症临床诊疗指南
来源:CSOBMR 发布日期:2022-01-18 15:32:09浏览:30920次
概述和流行病学
定义
甲状旁腺功能减退症(hypoparathyroidism,HP)简称甲旁减,是指甲状旁腺激素(parathyroid hormone,PTH)分泌过少和(或)效应不足而引起的一组临床综合征。其临床特征有低钙血症、高磷血症和由此引起的神经肌肉兴奋性增高及软组织异位钙化等,同时PTH水平低于正常或处于与血钙水平不相应的“正常”范围。
此外,还有一组由于外周靶细胞对PTH抵抗所致的临床综合征称为假性甲状旁腺功能减退症(pseudohypoparathyroidism,PHP),其具有与HP类似的生化表现,但PTH水平显著高于正常;部分并发典型的Albright遗传性骨营养不良(Albright’s hereditary osteodystrophy,AHO)。仅存在AHO特殊体征,但缺乏相应的生化及代谢异常者称为假—假性甲状旁腺功能减退症(pseudo-pseudohypoparathyroidism,PPHP)。
流行病学特征
HP为少见病,多数国家和地区缺乏患病率资料。在美国,估计HP患病率为37/10万人,丹麦为22/10万人;丹麦发病率约为0.8/100万人年。HP最常见病因是术后HP,其次是自身免疫性疾病和罕见的遗传性疾病,更罕见的病因包括甲状旁腺浸润性疾病、外照射治疗和放射性碘治疗甲状腺疾病。
PHP则更为罕见,一项研究调查了1998年全日本的PHP患者,推测其患病率接近0.34/10万人,其中58%为女性;2000年一项包括5 336 394名丹麦居民的研究推测PHP在丹麦的患病率约为1.1/10万人。
我国缺少HP及PHP的流行病学资料,但临床上术后HP患者逐渐增多,已经成为甲状腺、甲状旁腺和头颈外科手术面临的主要临床问题之一。
病理生理、病因和分类
病理生理
HP:主要病理生理改变由PTH分泌减少或作用障碍所致。PTH生成和分泌不足引起低钙血症、高磷血症、尿磷排泄减少。PTH不足通过以下途径导致低钙血症:(1)破骨细胞作用减弱,骨钙动员和释放减少;(2)1α-羟化酶水平下降,1, 25双羟维生素D[1, 25-dihydroxy-vitamin D,1, 25(OH)2D]生成减少,肠钙吸收减少;(3)肾小管对钙的重吸收减少。PTH不足同时还导致肾近曲小管对磷的重吸收增加,故尿磷排泄减少,血磷升高。
低钙血症使神经肌肉兴奋性增高,出现手足搐搦、口周及肢端麻木等临床表现。严重低钙血症或血钙水平急速下降时,患者可出现喉痉挛或癫痫样大发作。PTH不足导致骨转换水平减低,部分病程长的患者骨密度(bone mineral density,BMD)增加。儿童长期低钙血症可出现骨骼矿化障碍,表现为佝偻病/骨软化症。低钙血症可引起心电异常,表现为Q-T间期延长、非特异性T波改变等,并可伴发扩张性心肌病和心力衰竭等。低钙血症时维生素B12和内因子结合欠佳,可发生大细胞性贫血。微血管痉挛局部供血不足可引起外胚层器官营养障碍性病变,如皮肤粗糙、毛发脱落、干燥、牙釉质发育不良等。
升高的血磷携带钙离子在骨和软组织沉积,引起异位钙化和骨化。高血磷可能激活无机磷转运子PiT1(SLC20A1),并且导致尾状核和灰质中成骨因子的表达,导致基底神经节及其周边区域钙化,可引起震颤麻痹、癫痫发作等,严重者出现精神神经系统症状。钙、磷沉积在四肢、关节周围形成骨赘,出现关节疼痛、骨痛等;沉积在晶状体引起白内障。
由于PTH不足,肾小管重吸收碳酸氢盐过多,血pH值升高而引起碱中毒;肾小管对钠的重吸收过多而致水钠潴留,可表现为视乳头水肿、颅内压增高等。
PHP:由于受累靶器官对PTH抵抗,尽管血清PTH水平升高,仍出现低钙血症和高磷血症,血1, 25(OH)2D降低。肾脏近端肾小管对PTH抵抗,给予外源性的PTH不能如常刺激尿磷和环磷酸腺苷(cyclic adenosine monophosphate,cAMP)排泄。但部分患者肾小管升支粗段可能对PTH还存有反应,因此不易出现高钙尿症。持续的高PTH血症可导致骨转换水平升高,尤其是PHP中的Ⅰb型患者BMD水平低于HP患者,甚至出现三发性甲状旁腺功能亢进症。由于低钙和高磷血症,PHP患者同样会出现神经肌肉兴奋性增高和异位钙化等。
病因
HP:颈前手术是其最常见病因,大约占75%。甲状腺、甲状旁腺、喉或其他颈部良恶性疾病手术均可导致术后HP,术后低钙血症者中3%~30%的患者发展为慢性HP,其中甲状腺全切术可以造成多达7%的患者出现术后HP。多数学者认为如术后血钙<2.0 mmol/L(8.0 mg/dL)而PTH显著降低或者全段PTH(intact PTH,iPTH)<15 ng/L,即可考虑术后HP。此种状态在术后持续超过6~12个月即可诊断为永久性HP,甲状旁腺切除或其血供被阻断是造成永久性甲状旁腺功能损伤的原因。术后HP的疾病相关危险因素包括自身免疫性甲状腺疾病(格雷夫斯病或者桥本甲状腺炎)、胸骨后甲状腺肿、甲状腺肿复发再手术等。患者术前维生素D状态、手术范围、术者经验、术野暴露程度等多种因素会影响到术后HP的出现和程度。
术前维生素D缺乏是暂时性而非永久性HP的危险因素,推荐术前纠正维生素D缺乏。原位保留的甲状旁腺数目是发生暂时性和永久性HP风险的主要决定性因素。自体移植甲状旁腺是否有助于保留甲状旁腺功能尚存争议。甲状腺切除术后24 h内的PTH水平较血钙浓度能更准确地预测HP的发生。术后PTH水平低于10~15 ng/L时,建议口服补充钙剂和活性维生素D。
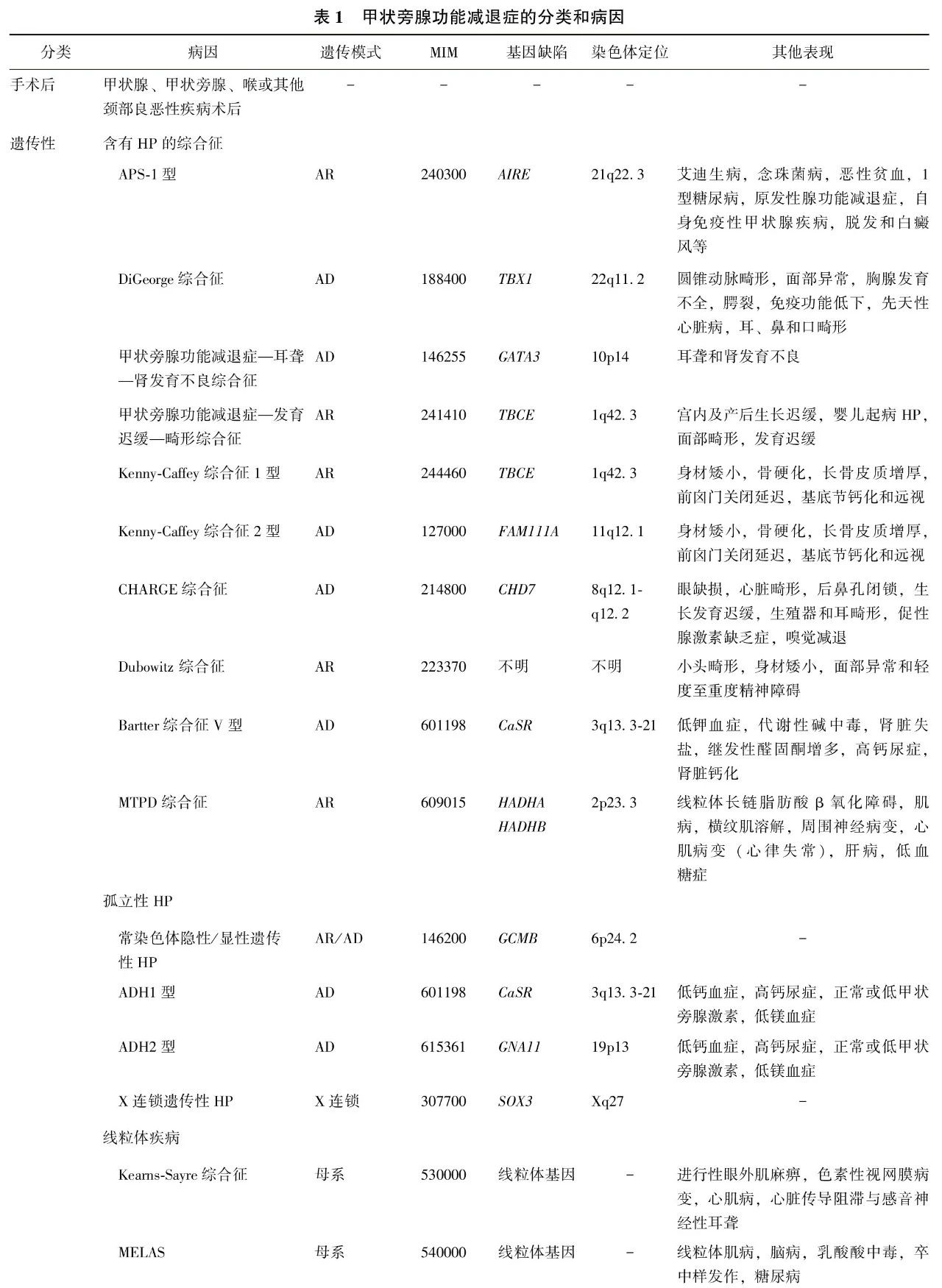
自身免疫性疾病和遗传是HP的第二大病因,可以造成孤立性HP,或者并发HP的综合征。基因缺陷可以为常染色体显性或隐性遗传,及X连锁隐性遗传,而线粒体DNA突变和缺失极为罕见。其中1型自身免疫性多发性内分泌腺病(autoimmune polyglandular syndrome type 1, APS-1)、DiGeorge综合征、甲状旁腺功能减退症—耳聋—肾发育不良综合征、以及1型和2型Kenny-Caffey综合征等均可能并发HP。Dubowitz综合征可出现HP,但其遗传缺陷尚未明确。
低龄起病、家族史、念珠菌病、多发性内分泌腺体功能减退等均应纳入遗传性HP考虑范围,需要遗传咨询和致病基因检测。
在自身免疫性HP中,已知APS-1型主要表现为HP、艾迪生病/原发性肾上腺皮质功能减退症、念珠菌病等,由
镁参与调节PTH的分泌,高镁血症和严重的低镁血症均抑制PTH的分泌和作用,呈现低PTH水平和低钙血症。镁参与腺苷酸环化酶的活化和cAMP介导的细胞内信号通路。慢性肾脏病(chronic kidney disease, CKD 4~5期)时尿镁排泄减少、锂治疗、摄入过多和静脉应用镁剂(宫缩抑制剂)可造成高镁血症。高镁血症可抑制PTH释放造成低钙血症,严重低镁血症同样可以显著减少PTH的分泌。摄入减少、吸收不良、排泄增多、分布异常以及遗传性疾病(如
浸润性病变如血色病和威尔森病造成铁和铜在甲状旁腺的沉积,也可以引起HP。原发性血色病和长期输血可造成铁负荷增加,除了HP外常并发其他内分泌疾病,如糖尿病、甲状腺功能减退症、骨质疏松症和性腺功能减退症。因地中海贫血接受长期输血治疗的患者发生HP的风险为10%~24%。积极的螯合剂治疗可以减少HP的风险,若铁蛋白>2 500 μg/L则发病风险显著增加。更为罕见的病因包括继发于肿瘤转移和电离辐射。
HP的病因和分类如
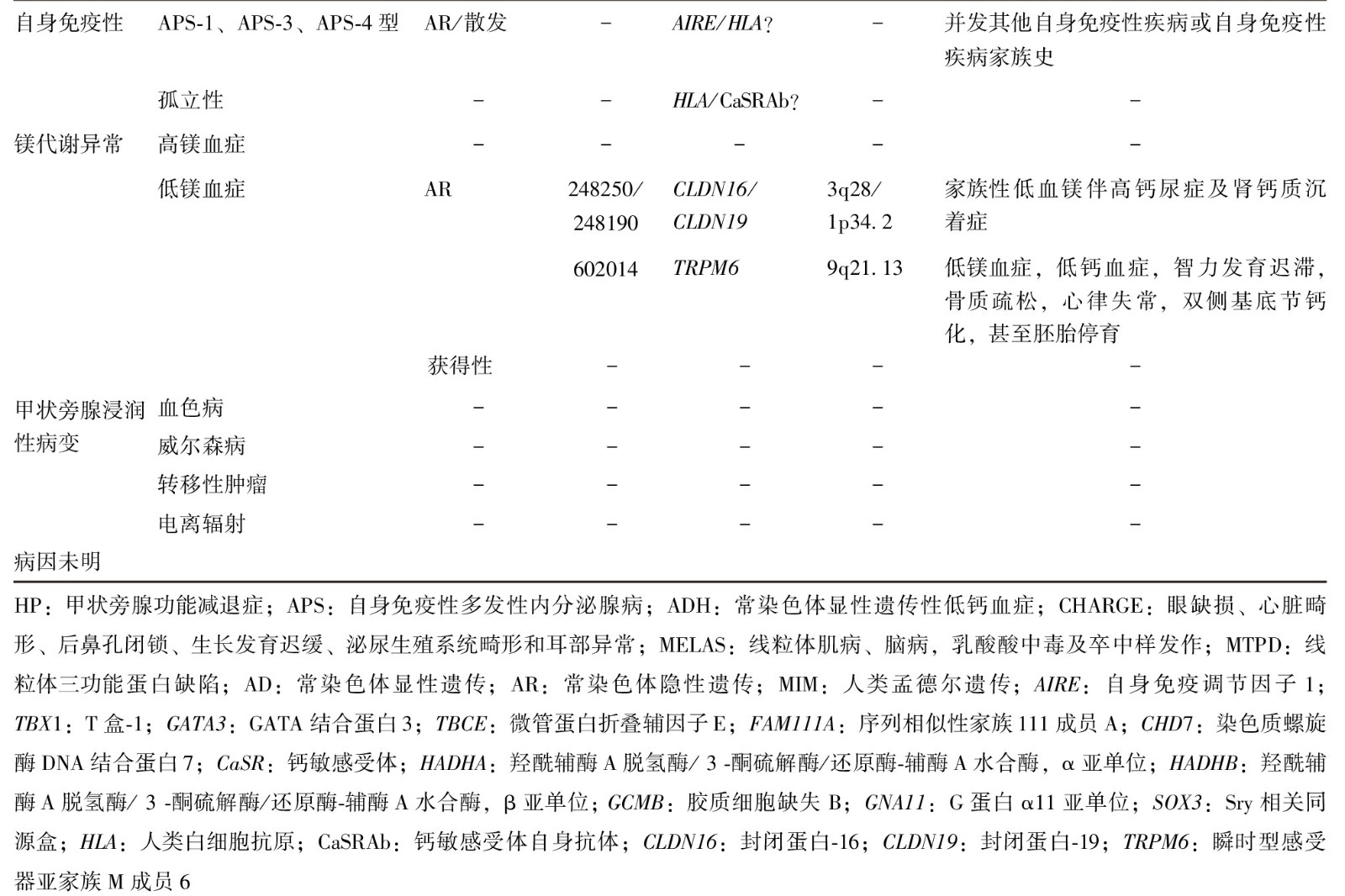
PHP:PTH抵抗是PHP的主要发生机制,通常由PTH受体后缺陷所致。根据注射PTH后尿液中cAMP水平是否升高分为PHPⅠ型(不升高)和Ⅱ型(升高,分子缺陷尚不明确),前者根据
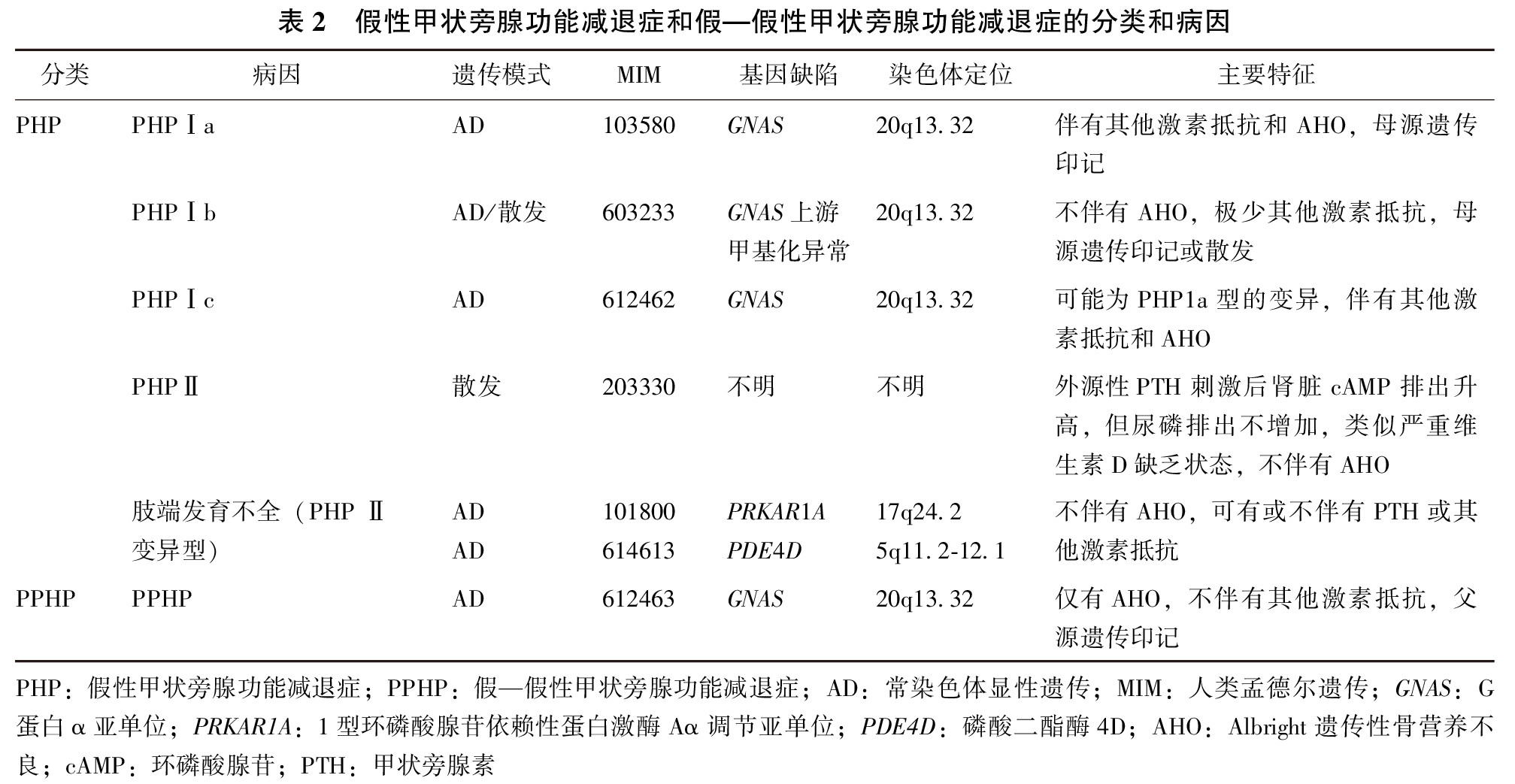
PPHP:PPHP与编码Gsα的父源性
临床表现
低钙血症和高磷血症是HP和PHP的临床生化特征,是否出现临床表现则取决于血钙下降的速度、程度及其持续的时间。
急性低钙血症
术后迅速发生的低钙血症可以出现急性低钙血症相关症状,典型表现为手足搐搦,有时可伴喉痉挛和喘鸣,甚至惊厥或癫痫样发作。
长期表现
HP导致的慢性低钙血症患者可能没有症状,除非血钙浓度降低到一定严重程度而出现神经肌肉兴奋性增加。高血磷通常无症状,但慢性高血磷会在血管、神经、肾脏等器官的软组织发生异位矿化,从而永久损害这些器官的功能。许多HP患者伴随慢性低镁血症,可能加重其临床症状。
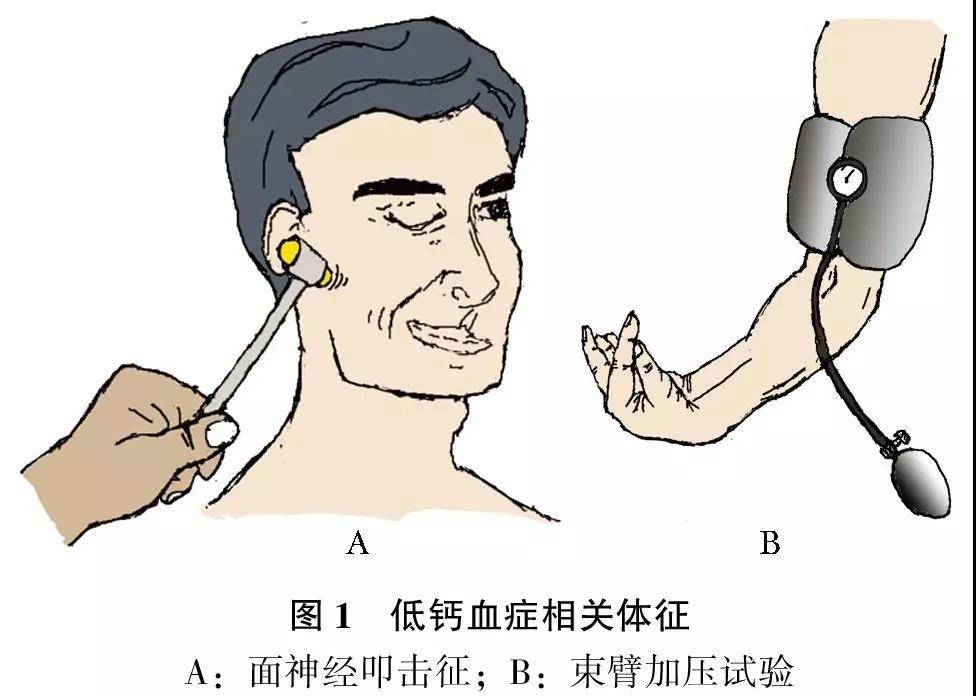
肌肉、神经和精神表现:患者可表现疲乏,四肢及口周麻木。神经肌肉兴奋性增高出现肌肉痉挛(有时疼痛),表现为手足搐搦、喉痉挛和哮鸣,支气管痉挛和哮喘。体检发现束臂加压试验(Trousseau)阳性和面神经叩击征(Chvostek)阳性(
外胚层营养不良:可出现皮肤干燥、浮肿且粗糙。其他皮肤表现包括毛发粗糙、脆弱和稀疏伴斑秃,以及具有特征性横沟的脆甲症。这些异常表现与低钙血症的严重程度及病程长短有关,待血钙恢复正常可逆转。
眼部表现:可引起白内障及角结膜炎,也可出现视乳头水肿和角膜钙化。
胃肠道症状:可有长期便秘,发作性腹部绞痛或伴有脂肪泻。
心血管系统:长期严重的HP可导致充血性心力衰竭、胸痛、心律失常,心电图出现心脏传导阻滞、长Q-T间期和ST-T改变。
骨骼:HP患者存在不同程度的骨骼异常。与正常对照相比,特发性或术后HP患者BMD可能增加。先天性甲状旁腺功能减退综合征患者可能有骨质硬化、骨皮质增厚和颅面骨畸形等改变。PHP患者的BMD改变则具有异质性,从类似HP的BMD升高、正常到类似原发性甲状旁腺功能亢进症的纤维囊性骨炎等均有报告。
牙齿异常:当低钙血症出现在发育早期时,可引起牙齿异常,包括牙齿发育不良、牙萌出障碍、牙釉质及牙根形成缺陷、龋齿磨损等。早期治疗低钙血症可逆转这些变化。
高钙尿症及肾脏并发症:患者处于低钙血症时尿钙水平也偏低,但由于PTH促进肾小管钙重吸收的作用缺失,使得HP患者的尿钙排泄相对较高,在钙和维生素D补充治疗过程中,随着血清钙水平恢复正常,容易发生高钙尿症,导致肾结石、肾钙沉着症,甚至引起慢性肾功能不全。
伴发疾病的临床表现
由于其他的一些疾病或者综合征可以导致HP,因此可出现伴发疾病的相关症状和体征,包括听觉丧失、肾功能异常、先天性畸形、身材矮小、免疫缺陷、心脏畸形、骨骼畸形等。APS-1型患者还可有念珠菌病、艾迪生病等表现(
PHP和PPHP的特殊临床表现
除了低钙血症和高磷血症所引起的相关临床表现外,PHPⅠa/Ⅰc型和少数PHPⅠb型患者也可有AHO表现,如身材矮小、皮下骨化、圆脸及短指(
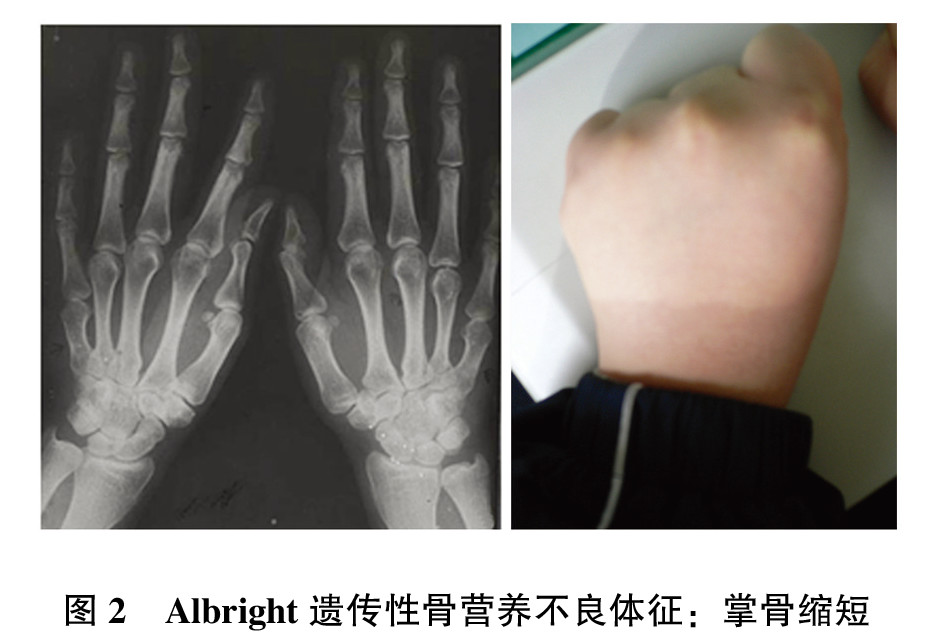
实验室检查
血钙:HP及PHP患者均存在低钙血症,血总钙水平≤2.13 mmol/L(8.5 mg/dL);有症状者,血总钙值多≤1.88 mmol/L(7.5 mg/dL),血游离钙≤0.95 mmol/L(3.8 mg/dL)。血总钙水平测定简便易行,但由于40%~45%的血钙为蛋白结合钙,因此在诊断时应注意血白蛋白对血钙的影响。常用计算公式为:血白蛋白每下降10 g/L(1 g/dL),血总钙下降0.2 mmol/L(0.8 mg/dL)。在低白蛋白血症时,血游离钙的测定对诊断有重要意义。
血磷:多数患者血磷增高,部分患者正常。
尿钙和磷:一般情况下,尿钙减少,尿磷排量也减少。但ADH患者尿钙排出增加,表现为高尿钙性低钙血症。接受钙和维生素D制剂治疗的HP患者,随着血钙水平的纠正,易出现高钙尿症。
骨转换指标:HP患者血碱性磷酸酶(alkaline phosphatase,ALP)水平正常,血β-Ⅰ型胶原羧基末端肽(β-isomerized carboxy-terminal cross-linking telopeptide of type Ⅰ collagen, β-CTX)水平可正常或偏低;部分PHP患者骨转换指标血ALP及β-CTX水平可高于正常。
血PTH:HP患者血iPTH水平一般情况下低于正常,也可以在正常范围。因低钙血症对甲状旁腺是一种强烈刺激,当血清总钙值≤1.88 mmol/L(7.5 mg/dL)时,血PTH值应有5~10倍的增加,所以低钙血症时,如血PTH在正常范围,仍属HP,测血PTH时,应同时取血测血钙,两者综合分析。PHP患者血iPTH水平高于正常。
影像学检查
建议应用头颅计算机断层照相术(computed tomography,CT)平扫评估有无颅内钙化及范围。应用裂隙灯检查评估是否并发低钙性白内障。应用腹部超声、必要时泌尿系统CT评估肾脏钙化/泌尿系统结石。如需要了解PHP患者的骨密度,可通过双能X线吸收测定法(dual energy X-ray absortiometry,DXA)进行检测。
诊断和鉴别诊断
HP的典型生化特征是低钙血症、高磷血症、PTH水平降低,结合临床表现,可作出诊断。PHP根据患者特殊的AHO体貌,结合低钙血症、高磷血症和过高的PTH水平可诊断。HP和PHP患者通常是因低钙血症及其相关症状(如手足搐搦、麻木等感觉异常)而就诊;也有患者因反复癫痫发作和(或)发现颅内钙化、白内障等就诊;PHP患者还可因高PTH血症、矮小、骨骼畸形(如AHO体型)等就诊,具有上述临床表现或生化异常的患者应考虑到HP或PHP的可能,进而完成鉴别诊断。主要的鉴别诊断包括低钙血症的鉴别诊断、HP病因的鉴别诊断及PHP的分型诊断等。
低钙血症的鉴别诊断
低钙血症的常见原因为甲状旁腺相关疾病,以及维生素D相关疾病。低钙血症还可根据PTH水平进行分类:低PTH所致的低钙血症见于各种原因导致的永久性或一过性HP(

一旦确定低钙血症,应针对低钙血症的常见原因进行细致的临床评估,包括颈部手术史,某些药物应用史,血维生素D代谢物水平、血镁水平及肾功能等。宜同时测定血钙、磷、PTH、25羟维生素D(25 hydroxyvitamin D, 25OHD)、血镁、血肌酐、肌酸磷酸激酶及24 h尿钙等水平。通常维生素D缺乏或抵抗所致低钙血症常伴有低磷血症、血PTH升高,严重者可表现为骨软化症或佝偻病。而HP或慢性肾功能不全相关的低钙血症常表现为低钙血症、高磷血症,可根据血PTH水平进一步分析。
HP病因学筛查
HP的典型生化特征是低钙血症、高磷血症、PTH水平低下或测不到;但在很少情况下,某些突变型HP的PTH通过一些方法测定可能升高。1, 25(OH)2D和骨转换指标包括ALP通常低于正常或在正常范围偏低水平,低血钙情况下尿钙排泄量减少,肾小管重吸收磷增加,血磷升高。
HP可由甲状旁腺发育不良(多种基因突变)、破坏(颈部手术或自身免疫性疾病)、PTH分泌减少(新生儿低钙血症或低镁血症)、对PTH抵抗(如PHP)及由
对于无颈部手术史的患者,如果具有综合征的相关表现、HP或自身免疫性疾病家族史,尤其是起病年龄较轻的患者,可考虑进行相关基因检测和(或)家系筛查。血镁水平异常也可影响甲状旁腺功能,许多HP患者同时并发慢性低镁血症,镁缺乏可以加重HP患者低钙血症的症状和体征,应注意同时检测血镁水平,必要时予以纠正后复查甲状旁腺功能。若可排除手术后和遗传性病因所致的HP(综合征和非综合征性)以及镁缺乏或过多等因素所致,要考虑到一些少见的病因,如浸润性疾病、威尔森病和血色病等。
PHP分型诊断
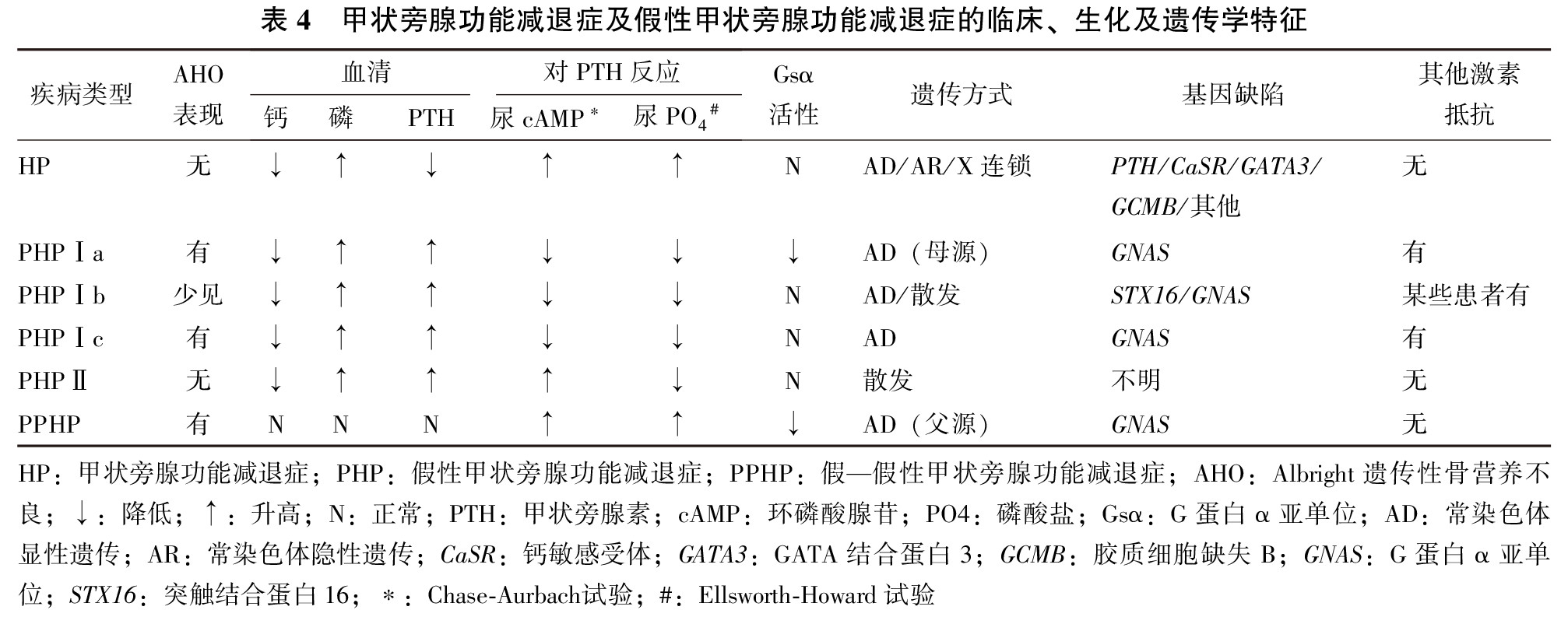
如患者表现为低钙血症、高磷血症同时PTH水平升高,要考虑PHP。HP及PHP的临床、生化及遗传学特征见
诊疗流程
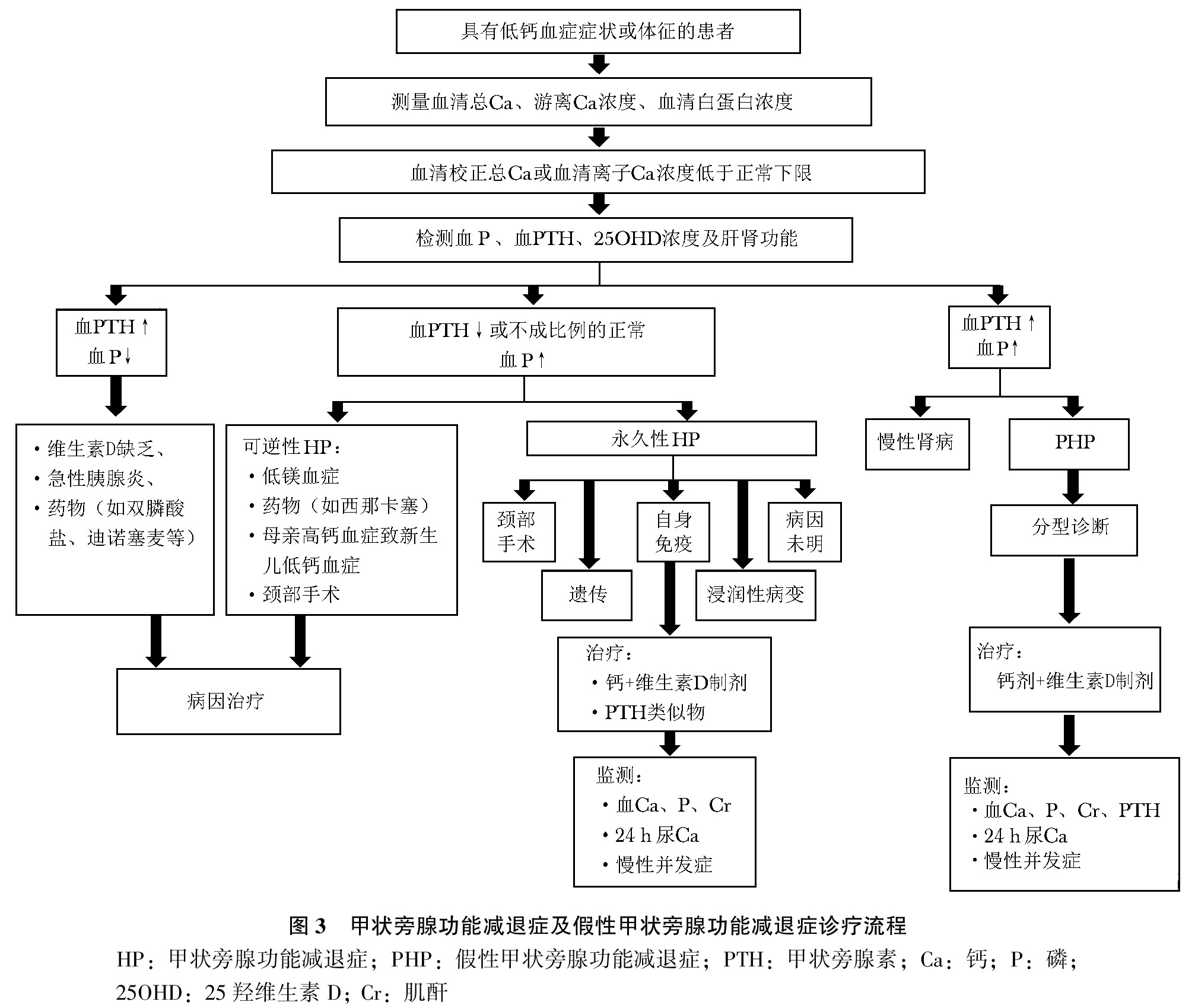
见
治疗
急性低钙血症的处理
处理原则为补充钙剂和活性维生素D,并需纠正低镁血症。治疗目标为将血钙升至正常低值或略低,缓解临床症状和低血钙的并发症;同时,避免治疗后继发的高钙血症和高钙尿症。
补充钙剂:对有手足抽搐等低钙血症症状及体征的患者,均需积极采取静脉补钙治疗。用10%葡糖酸钙10~20 mL缓慢静脉推注(90~180 mg元素钙,10~20 min),通常症状立即缓解;如果症状复发, 必要时可重复。对于症状反复多次出现难以缓解者,可持续静脉滴注钙剂,每日补充大约500~1 000 mg元素钙,即将10%葡糖酸钙100 mL(930 mg元素钙)稀释于5%葡萄糖液1 000 mL内按每小时50 mL(45 mg元素钙,不超过元素钙4 mg/kg体质量为宜)的速度静脉滴注,钙剂溶液的最高浓度最好控制在100 mL溶液内元素钙小于200 mg,即100 mL溶液稀释不超过20 mL的10%葡糖酸钙,以免刺激血管。避免输液外渗,刺激周围软组织;输液期间定期复查血钙,避免血钙水平过高。维持血清钙2.0 mmol/L左右即可。若发作严重,可短期内辅以地西泮或苯妥英钠肌肉注射,以迅速控制搐搦与痉挛。如低血钙仍然不能纠正,症状不能缓解,可同时口服每日1 000~2 000 mg元素钙。
使用活性维生素D:由于HP患者缺乏PTH,活性维生素D的生成受阻,需要给予活性维生素D才能迅速纠正肠钙的吸收障碍,骨化三醇常用剂量为0.25~2 μg/d或更大剂量,分次口服,起效快,口服3~6 h后血药浓度达峰值,半衰期为5~8 h。
纠正低镁血症:低镁血症常与低钙血症并存,低镁血症时PTH分泌和生理效应均减低,使低钙血症不易纠正。严重低镁血症(低于0.4 mmol/L)患者可出现低钙血症和手足搐搦。因此,在补充钙剂和应用维生素D的同时,尤其病程长、低血钙难以纠正者,予以补镁,有助提高疗效。给予10%硫酸镁10~20 mL缓慢静脉注射(10~20 min),如血镁仍低,1 h后还可重复注射;肌肉注射容易产生局部疼痛和硬结,一般较少使用。除静脉注射外,还可口服氯化镁3 g/d或静脉滴注10~14 mmol/L,肾排泄镁功能正常的患者尿镁可作为体内镁补充适量的指标。
HP及PHP的长期治疗
HP及PHP常规长期治疗是口服钙剂、活性维生素D或其类似物,以及普通维生素D(

钙剂:以碳酸钙最为常用,含元素钙40%,由于需胃酸才能解离为可吸收的钙离子,餐时服用较好。而枸橼酸钙虽含元素钙较碳酸钙低,但其解离不需要胃酸,任何时间都可服用,尤其适用于胃酸较少者,包括长期服用质子泵抑制剂的患者。在不良反应方面,碳酸钙容易引起便秘,而枸橼酸钙不易引起便秘。其他种类的钙剂包括葡乳醛酸钙、葡萄糖酸钙和乳酸钙含钙量较低(分别为6.6%、9%和3%),一般不常用于HP的治疗。每次补元素钙500~1 000 mg,2~3次/d。
活性维生素D或其类似物:维生素D的活性代谢产物为1, 25(OH)2D,具有促进肠钙吸收和骨转换的生理作用,由于PTH刺激25OHD-1α-羟化酶的合成,PTH的缺乏或作用障碍将导致维生素D活化障碍,因此活性维生素D与钙剂合用是治疗HP的重要手段。骨化三醇一般服药1~3 d后可见血钙上升,用量为0.25 μg/d至2 μg/d,相当于体内每日产生1, 25(OH)2D的量,必要时每日用量可超过2 μg,如每日用量大于0.75 μg,则需分次服用。如有条件,在使用活性维生素D期间,可检测血清1, 25(OH)2D水平,以判断是否存有依从性差和(或)肠道吸收不良。
1α-羟基维生素D(阿法骨化醇)和双氢速甾醇为活性维生素D类似物,可作为骨化三醇的替代品,它们分别在肝脏转化为1, 25(OH)2D和25羟基双氢速甾醇而发挥作用。阿法骨化醇也是在服药后1~3 d后出现血钙上升,但作用时间较骨化三醇长,为5~7 d。而双氢速甾醇起效较慢,在服药4~7 d后可见血钙上升,作用时间比阿法骨化醇更长,为7~21 d。阿法骨化醇的常用剂量为0.5~3.0 μg/d,双氢速甾醇的常用剂量为0.2~1.0 mg/d。由于骨化三醇作用时间短,如治疗期间血钙过高,停药后血钙很快回降,而双氢速甾醇作用时间长,一旦发生高钙血症,停药后血钙回降较慢,阿法骨化醇介于两者之间。
普通维生素D:普通维生素D在肝脏羟化后转变为25OHD,后者半衰期较长(2~3周),25OHD在高浓度时,也能激活维生素D受体。在用活性维生素D的同时,需补充普通维生素D,将25OHD维持在正常范围,能使血钙更趋稳定,且为PTH非依赖性肾外组织合成1, 25(OH)2D提供足够底物,以充分利用肾外组织产生1, 25(OH)2D的能力。普通维生素D包括维生素D2和维生素D3,两者活性相似。本指南建议将25OHD维持在75 nmol/L以上。
如无法得到活性维生素D或其类似物,或无法承受其费用,可考虑用价格较便宜的普通维生素D代替,但需使用中毒剂量才能达到疗效,值得注意的是,如25OHD在脂肪组织中蓄积过多,释放入血时,将会导致严重高钙血症,且持续时间较长。因此用中毒剂量的普通维生素D代替活性维生素D或其类似物时,需严密监测血钙,慎防高钙血症的发生。
妊娠及哺乳期的HP及PHP患者,建议应用活性维生素D及其类似物联合钙剂维持血钙水平。
其他辅助治疗:噻嗪类利尿剂能增加肾远曲小管对钙的重吸收,从而减少尿钙排泄,针对大剂量钙剂和活性维生素D或其类似物所致的高尿钙,噻嗪类利尿剂常作为一种辅助治疗方法。低盐饮食能增强噻嗪类利尿剂的作用。噻嗪类利尿剂一般在服药第3~4天可见血钙上升。双氢克尿塞的常用剂量为25~100 mg/d,由于该药半衰期较短,常需分两次服用。氯噻酮为另一种噻嗪类利尿剂。需注意的是,用噻嗪类利尿剂提升血钙时所需剂量较大,而大剂量又容易引起低钾、低镁和低钠血症,因此,常需联合补钾,或与保钾保镁利尿剂如阿米洛利联用,以防止低钾和低镁血症的发生。如并发原发性肾上腺皮质功能减退症(APS-1型),则不建议使用噻嗪类药物,以免出现低钾血症。由钙受体失活性突变所致的低钙血症患者常伴有低镁血症,也不建议使用噻嗪类药物。另外,在患者并发有其他疾病而需要用利尿剂时,建议选用噻嗪类利尿剂,而不是袢利尿剂。
除非发生严重高磷血症,磷结合剂或低磷饮食常无必要。对于钙受体失活性突变所致的低钙血症患者,由于尿镁丢失过多,常需补充镁剂。
癫痫的治疗:建议癫痫发作时予以常规的抗癫痫治疗,同时针对HP治疗,在血钙水平达标后逐渐减少抗癫痫药物,部分患者可以停用抗癫痫药物。
HP常并发白内障,需手术治疗。
HP患者常有骨微结构异常和BMD升高,其临床意义并不确定,不需特异性的治疗。
随访监测:治疗期间,需监测血钙(用白蛋白水平校正)、血磷和血肌酐,在药物剂量调整期间每周至每月检测上述指标,药物剂量稳定后每半年检测上述指标及尿钙和尿肌酐;PHP患者还需监测血PTH水平。
常规治疗往往因治疗不足导致长期肌肉抽搐或治疗过度导致高血钙或高尿钙,因此需长期监测血钙和尿钙。尽管HP患者空腹血钙的目标值较为明确,但由于个体差异,可根据临床症状进一步调整目标血钙的水平。
HP患者可出现异位钙化和肾结石,但很难区分是由于HP本身所致还是治疗药物引起,一般认为,只有高剂量的钙剂和维生素D才有可能引起异位钙化和肾结石。对于HP,治疗前常需行肾脏超声或CT检查以确定是否存有肾结石或钙质沉着症,治疗期间可每5年重复一次检查,如临床症状出现变化,可将检查提前。
科普教育:需重视科普教育,让患者了解HP及PHP的病理生理、临床表现和治疗方面的一些知识,特别是让患者及家人了解定期检查随访的重要性,重视高尿钙的危害,理解24 h尿钙等一些繁琐检查的必要性,以预防或延缓长期并发症的发生。
PTH替代治疗
尽管使用大剂量钙剂和活性维生素D,部分HP患者的血钙仍然不能被提升到目标水平,并且,长期使用大剂量钙剂和活性维生素D有可能引起高尿钙、肾结石、肾钙质沉着症和异位钙化。此外,用钙剂和维生素D治疗并不能解决由于PTH缺乏所致的骨转换降低的问题。而使用PTH替代治疗的明显优势是PTH在纠正低钙血症的同时显著降低了尿钙水平,因此PTH替代治疗与常规治疗相比不会发生高尿钙、肾结石和肾钙质沉着症。并且能纠正常规治疗不能纠正的骨代谢异常。
在激素缺乏导致的内分泌疾病中,HP是最后一种应用激素替代治疗的疾病,直至1996年Winer等才首次报告了用重组人甲状旁腺素1-34片段(rhPTH1-34)治疗HP的临床研究结果。目前在临床研究中,用于HP治疗的PTH及其类似物包括两种:rhPTH1-34(Teriparatide)和rhPTH1-84(Natpara),后者于2015年1月获得美国食品药品监督管理局(U.S. Food and Drug Administration,FDA)批准用于治疗HP。
PTH1-34:Winer等自1996年以来进行了多项关于PTH1-34治疗HP的临床研究,均能有效维持血钙在目标范围,且与传统治疗药物(活性维生素D)相比尿钙排泄明显减少;2次/d可较1次/d注射明显减少PTH1-34的剂量,且皮下注射泵可进一步减少用量。PTH1-34治疗1年后,骨转换指标水平显著升高,全髋BMD显著增加而桡骨远端BMD显著降低,小梁骨数量、矿化表面积及骨形成速率均显著增加。
PTH1-84:与PTH1-34治疗方案不同,临床研究中采用在原有传统治疗基础上加用每日或隔日1次固定剂量PTH1-84的方案。临床研究显示加用rhPTH1-84后,元素钙和骨化三醇用量可显著降低甚至停用,血磷水平显著降低,尿钙水平不增加或维持正常范围;骨转换指标水平显著升高;腰椎BMD升高,全髋BMD不变或升高,而桡骨远端BMD显著降低。骨组织计量学研究结果与PTH1-34类似,应用PTH1-84亦可显著增加骨转换指标水平、皮质骨多孔性及小梁骨数量。
由于rhPTH1-84非常昂贵,美国内分泌学会推荐rhPTH1-84做为钙剂和维生素D制剂的补充治疗,用于单纯传统治疗效果不佳的患者,包括:(1)血钙波动较大,经常出现明显的低钙血症或高钙血症;(2)血磷和(或)钙磷乘积控制不满意;(3)调整传统治疗药物后仍有高钙尿症导致的肾脏并发症或泌尿系结石风险增加;(4)已有肾脏并发症,包括肾脏钙化、肾结石或慢性肾脏疾病;(5)口服药物剂量过大;(6)并发影响钙和维生素D吸收的胃肠道疾病;(7)
目前rhPTH1-84用法为起始剂量50 μg,皮下注射,1次/d;同时将原有活性维生素D剂量减半。开始用药或调整剂量后每3~7天监测血钙水平,每4周调整rhPTH1-84的剂量,治疗目标为停用活性维生素D,口服元素钙减为500 mg/d,维持血钙在正常低值水平。如原用元素钙剂量较大,也可以从减少钙剂剂量起始。剂量稳定后,建议每3~6个月检测血钙磷水平,至少每年检测1次尿钙水平。
如需将rhPTH1-84治疗改回传统治疗,建议停药前检测血清25OHD水平,确保25OHD在正常范围。如为单纯应用rhPTH1-84的患者,停药前需要与传统治疗药物短期重叠以待后者起效。在PTH治疗向传统治疗转换时,有时需要短时期增加传统治疗药物剂量。
应用rhPTH1-84的不良事件包括高钙血症、低钙血症、肌肉骨骼症状、胃肠道症状等。目前并未观察到应用rhPTH1-34或rhPTH1-84过程中骨肉瘤风险的增加。对于rhPTH1-84治疗HP的疗程,尚不明确。
