成骨细胞分泌的新型厌食因子:脂质运载蛋白2
来源:CSOBMR 发布日期:2019-12-17 15:45:40浏览:17031次
作者:刘媛1 李世昌1 徐帅2
单位:
1、华东师范大学青少年健康评价与运动干预教育部重点实验室
2、淮阴师范学院体育学院
摘要:骨骼作为一种全新的内分泌器官,通过自分泌、旁分泌或远距分泌活性因子参与糖脂代谢、骨代谢、细胞增殖及认知等生命活动。最新研究发现,成骨细胞分泌脂质运载蛋白2(lipocalin-2,LCN2)穿过血脑屏障,参与下丘脑LCN2-黑素皮质素受体-4(melanocortin receptor-4,MC4R)-环磷酸腺苷(cyclic adenosine monophosphate,cAMP)食欲调控通道以抑制食欲,进而影响能量代谢,但其作用机制尚未明确。既往研究发现,LCN2可在许多组织中表达,参与炎症、免疫调节、肿瘤及心血管疾病等多种生理病理活动。本文主要以LCN2相关文献为理论基础,整理归纳成骨细胞分泌LCN2的功能及作用机制,为肥胖症机制提供新的视角。
关键词:成骨细胞;骨内分泌;厌食;脂质运载蛋白2
随着生活方式及饮食结构的改变,久坐已成为常见的行为习惯,肥胖、心血管疾病等慢性疾病的发病率也在逐年提高。如何控制体重成为社会研究热点问题。近期研究发现成骨细胞分泌的脂质运载蛋白2(lipocalin-2,LCN2),能够经过血液循环,穿过血脑屏障,作用于下丘脑参与食欲控制及能量代谢,进而发挥控制体重的作用,也因其这一功能,被称为新型“厌食因子”。本文以成骨细胞分泌活性因子LCN2作为切入点,研究骨源性通过LCN2参与控制食欲、能量代谢及控制体重的作用机制。
众所周知,下丘脑是中枢神经系统中重要的调控区域,参与调控动物的节律性活动。此外,下丘脑还是人类和动物摄食及能量代谢调节的重要区域,下丘脑神经元可感知外周的能量信号(如饥饿、饱腹等),再通过中枢信号及某些激素以相互协调的方式影响食物摄取和能量代谢来共同控制体重。现常见的激素和肽包括瘦素、胰岛素、胰高血糖素样肽-1、胆囊收缩素等,它们均产生于不同的外周器官,通过下丘脑、脑干或传入植物神经中的信号传导来控制食物摄取;但后续研究发现,除了上述激素外,机体中可能还存在其他控制食物摄取的因子。下丘脑发挥控制食欲的功能主要由黑素皮质素受体-4(melanocortin receptor-4,MC4R)介导的控制食欲信号通路发挥重要作用。此外,影响MC4R控制食物摄取的因子除了促黑素细胞激素(α-melanocyte-stimulating hormone,α-MSH)、刺鼠基因相关蛋白(agouti gene-related protein,AGRP)等,还存在其他尚未明确的因子来激活或者抑制MC4R介导的控制食欲通道来影响食欲及摄食量等。
骨骼一直被认为是支持、保护机体基本结构和参与运动及钙磷代谢的主要器官。现有研究发现,骨骼不再是“沉默”器官,它能够合成和分泌多种生物活性因子,参与自身及机体的代谢活动。其主要发挥作用的有成骨细胞、破骨细胞、软骨细胞及骨细胞。它们不仅可以通过自分泌或旁分泌的方式调节骨代谢及维持骨骼的生长、发育及修复等;还可以通过循环系统以远距分泌的方式参与机体其他器官或组织的代谢及全身能量代谢的调节。骨骼分泌的多种骨调节蛋白如骨保护素(osteoprotegerin,OPG)、骨形态发生蛋白(bone morphogenetic protein,BMP)及脂联素等脂肪因子、胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)等不同程度地促进成骨细胞的增殖分化,促进骨形成;还可以分泌骨桥蛋白(osteopontin,OPN)及白介素1(interleukin-1,IL-1)、白介素6(interleukin-6,IL-6)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等炎症因子均参与破骨细胞对骨的再吸收过程。在骨的生长发育过程中,主要由成骨细胞和破骨细胞相互协调共同维持骨微环境,使骨密度处于正常水平,发挥正常生理功能。
骨骼系统除参与上述自身调节外,其分泌的活性因子还可参与糖脂代谢、钙磷代谢等。但在复杂的机体环境中,骨源性因子参与上述代谢发挥多大的作用,并无定量且确切的报道,有待进一步研究。已有研究发现,至少有三种来自骨细胞的激素或者“因子”具有内分泌功能:由成骨细胞和骨细胞产生成纤维细胞因子23(fibroblast growth factor 23,FGF-23),可调节磷酸盐代谢;由成骨细胞分泌骨钙素(osteocalcin,OCN)可调节全身的葡萄糖及能量代谢,并具有调节增殖和认知功能;由成骨细胞分泌的LCN2通过下丘脑的食欲控制通道来调控食欲,进而影响能量代谢、控制体重。
近日,来自瑞典哥德堡大学神经科学与生理学研究所的John教授带领的研究团队发现了一套全新的“基于下肢承重骨细胞的脂肪含量调节系统”, 下肢骨细胞可以感受机体重量的变化:当体重增加时,其可以感受机械应激,并将此信号传递到下丘脑,刺激下丘脑神经元,抑制食欲、分解脂肪以及改善血糖水平;反之,当体重减轻时,其也会将此变化信号传递到下丘脑,增强食欲、增加脂肪合成等调节。久坐人群因长期处于坐姿,下肢骨细胞对体重变化的感知不敏感或不正确,导致此系统调节紊乱。这一重大发现,一方面为解释久坐人群更容易出现肥胖、心血管疾病等提供新的思路,另一方面再一次验证了骨可参与机体其他生理活动,特别是骨参与食欲及能量代谢的调节。
LCN2的发现
1993年,Kjeldsen等首次发现LCN2,又称中性粒细胞明胶酶相关脂质运载蛋白(neutropil gelatinase-associated lipocalin,NGAL)或噬铁蛋白,是分子质量为25 kDa的糖蛋白脂肪因子。后续研究发现,LCN2在其他组织或细胞中(如肝细胞、活化的淋巴细胞及多种上皮细胞等)可表达发挥作用,但白色脂肪组织被认为是LCN2的主要来源。
骨外LCN2的角色
Guo等通过敲降LCN2基因小鼠实验发现,LCN2-/-小鼠对饮食诱导的肥胖更敏感,脂肪组织重量和脂肪细胞体积明显高于野生型小鼠。既往研究认为,LCN2可作为能量代谢的关键调节剂控制食欲。而研究证实,脂代谢与骨代谢间存在复杂的关系,脂肪组织通过内分泌或旁分泌方式参与骨代谢调节。LCN2可以通过调节铁代谢参与细菌感染的非特异性免疫,还能够诱导多种细胞凋亡,也可以参与抑制肿瘤的发生。如Celestino等通过基因鉴定的方式发现细胞视黄素结合蛋白-1 (cellular retinoic acid binding protein-1,CRABP1)的低表达和LCN2的过表达可作为恶性甲状腺肿瘤有用的诊断生物标志物,且LCN2过表达可促进其恢复。反应性星形胶质细胞分泌的LCN2是一种神经毒性介质,但其对神经元具有选择性毒性,即对原代神经元具有毒性,对星形胶质细胞、小胶质细胞等均无毒性,能够促进神经细胞死亡。LCN2还通过参与炎症、糖脂代谢、影响心肌细胞凋亡等影响心血管疾病的发生发展。
LCN2与骨
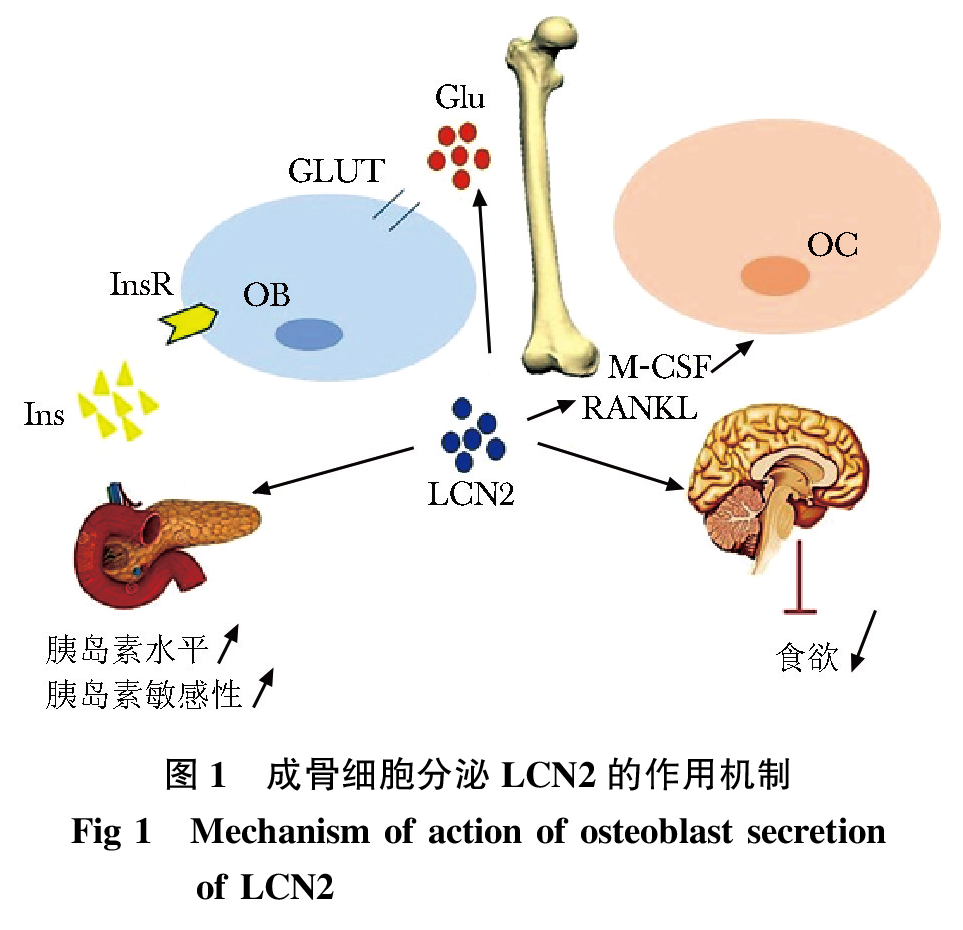
LCN2与成骨细胞:骨作为新型的内分泌器官,能够分泌OCN和FGF23等因子,作用于远端器官以影响全身能量代谢。后续研究发现当成骨细胞数量减少50%会降低OCN的水平并损害葡萄糖代谢。值得注意的是,其食欲也因此受到了影响,表现为食物摄入量增加,而给予OCN补充剂是无法改善这一症状,排除了OCN调节食欲的假设。但可确定控制食欲是由成骨细胞调节的一代谢功能,存在其他的骨源性激素调节此能量代谢。为了找寻成骨细胞中控制食欲的信号源,在特异性敲降成骨细胞Foxo1(Foxo1osb-/-)小鼠的研究发现,其能量代谢有所改变,Foxo1osb-/-小鼠中成骨细胞中编码LCN2的基因表达上调,在骨和血清中LCN2水平上升。且发现成骨细胞中LCN2的表达水平是白色脂肪细胞的十倍高,打破了LCN2主要由脂肪组织分泌的与肥胖相关的脂肪因子的认知。
成骨细胞分泌LCN2作用:研究人员分别特异性敲降成骨细胞中LCN2基因(LCN2osb-/-)、脂肪细胞中LCN2基因(LCN2fat-/-)、全身细胞中LCN2基因(LCN2-/-)以构建3种不同基因敲降小鼠模型,明确不同组织分泌LCN2与食欲的关系。研究发现,LCN2fat-/-小鼠食欲无明显变化;而LCN2osb-/-小鼠表现为食欲增加,同时葡萄糖耐受量、胰岛素敏感性及血清胰岛素水平降低,脂肪和体重增加;LCN2-/-小鼠所表现出的症状和LCN2osb-/-小鼠表型一致。并且,一项敲降不同年龄段小鼠LCN2基因研究发现,骨髓脂肪细胞和白色脂肪细胞都不会影响循环血液中调节食欲和葡萄糖代谢的LCN2水平。虽然LCN2在许多组织中可以表达,但发挥的作用却不尽相同。上述实验证明,在机体内只有成骨细胞分泌的LCN2才具有参与体内食欲调控的作用。
Mosialou等还发现LCN2-/-小鼠表现出食欲过盛,腹腔注射外源性LCN2使其恢复正常血清水平,2 h内,LCN2在下丘脑部出现积累;在野生型小鼠中,禁食后再喂食也会出现下丘脑中LCN2水平的上升。当对LCN2-/-小鼠脑室内注射正常剂量的LCN2后,发现LCN2-/-小鼠食欲恢复正常,小鼠增重情况得以改善。
对野生型小鼠进行一夜禁食后再喂食发现,血清中成骨细胞分泌的LCN2在再喂食后的1~3 h内增加,而食欲则被抑制。小鼠进食后在成骨细胞中编码LCN2的基因表达上调,以表达更多的LCN2来抑制食欲。Mosialou等通过对瘦素缺乏小鼠进行16周的外源性给予LCN2治疗实验研究发现,LCN2在一定程度上抵消了瘦素缺乏对小鼠食欲和能量消耗的影响。且在肥胖小鼠中,通过LCN2表达上调可改善肥胖、炎症和胰岛素抵抗等症状。
在进行LCN2信号是否能直接影响胰岛β细胞功能的检查验证时发现,LCN2的降食欲功能会影响脂肪量堆积、体重和胰岛素敏感性,而LCN2可直接所用于胰岛细胞,刺激胰岛素的分泌及提高葡萄糖耐量和胰岛素敏感性。在研究2型糖尿病时发现,体重和糖基化血红蛋白量与LCN2水平呈负相关。
葡萄糖是机体能量代谢的主要来源。与野生型小鼠相比,LCN2-/-小鼠表现为较低的血糖及高胰岛素血症,并且其葡萄糖耐受性高于野生型小鼠但其胰岛素耐受性并无差异。在成骨细胞表面存在胰岛素受体(insulin receptor,InsR)及葡萄糖转运蛋白(glucose transporter,GLUT),在成骨细胞中GLUT缺失的小鼠中不仅表现出骨微结构的受损,也表现出较低的血清胰岛素水平及高血糖症,而成骨细胞GLUT过表达则会增加血清胰岛素水平及降低血糖水平。而且成骨细胞分泌的LCN2也可影响胰岛素敏感性及能量代谢。后经研究发现,LCN2可作用于GLUT,进而促进能量代谢。Kim等通过在成骨细胞中过表达LCN2的转基因小鼠实验中证实LCN2参与骨骼发育和成骨细胞的分化,并且还观察到LCN2也可在破骨细胞增殖分化中发挥作用。Rucci等发现LCN2可作为一新型的机械效应因子,感知体力活动或者外界刺激对骨的影响,对低机械力的病理反应及维持骨稳态至关重要。Lim等已证明循环血液中LCN2水平可以预测骨质疏松性骨折发生的风险,对骨质疏松的防治具有重要临床意义。研究还发现,LCN2可以通过Runt相关转录因子2(Runt-related transcription factor 2,RUNX2)影响成骨细胞分化、软骨细胞成熟及破骨细胞形成,调节骨微环境。进一步研究发现,LCN2通过巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)和破骨细胞分化因子(receptor activator for nuclear factor-κB ligand,RANKL)介导的破骨细胞发育过程,抑制破骨细胞前体的增殖和分化,导致破骨细胞形成减少。但Costa等认为成骨细胞过表达LCN2可促进骨吸收,抑制骨重构。因此,在不同的生理病理环境中,骨表达LCN2水平不同,功能不同(图 1)。
成骨细胞分泌LCN2调控食欲机制
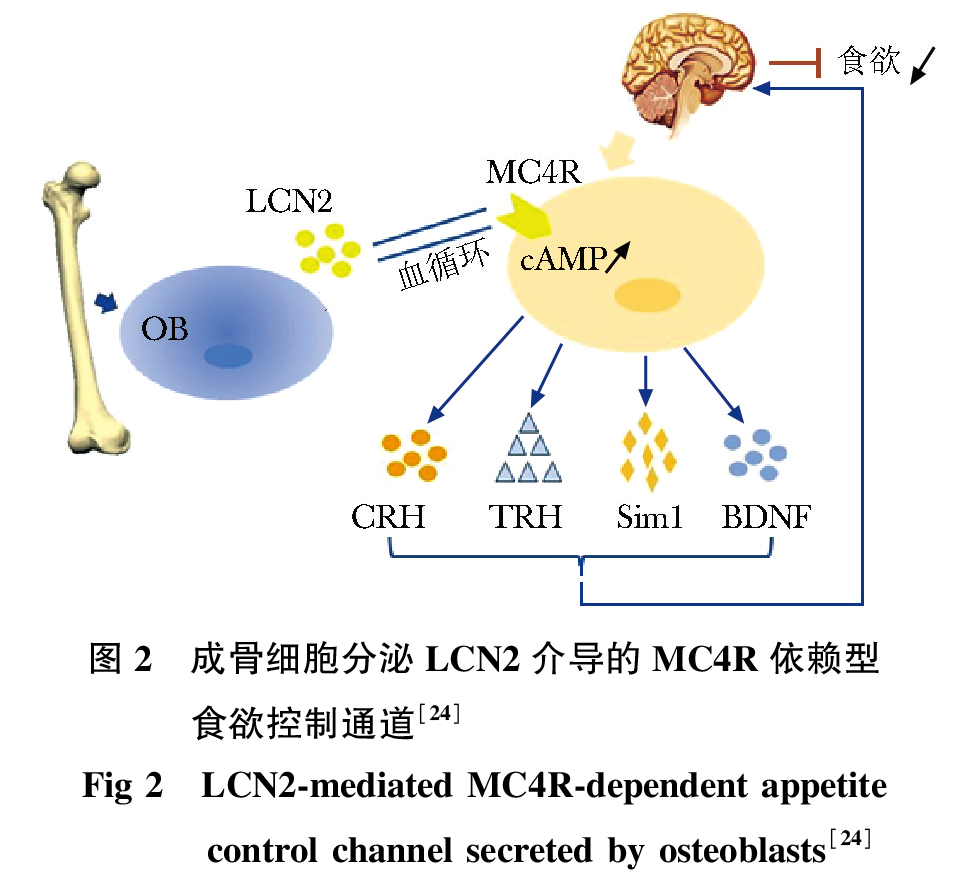
下丘脑上的MC4R为LCN2的受体,并且LCN2对MC4R缺失小鼠(MC4R-/-)食物摄入或糖代谢没有生物学影响。成骨细胞分泌的LCN2穿过血脑屏障后与下丘脑的MC4R结合,发挥其控制食欲及调控能量代谢的功能。关于成骨细胞分泌的LCN2和MC4R结合后又如何控制食物摄入量的问题,Mosialou等通过动物实验及生物电、生理生化检测等方面做出了验证,表现为:(1)荧光标记的成骨细胞分泌的LCN2可以在下丘脑中检测到;(2)LCN2与MC4R结合后会引起电生理反应,且细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)活性升高;(3)用同水平的LCN2处理MC4R-/-小鼠和野生型小鼠并进行比较,发现野生型小鼠出现食欲减退和体重下降,而MC4R-/-小鼠并无此现象;(4)通过离体细胞培养实验发现LCN2可以诱导正常MC4R细胞中的cAMP活性升高,而在MC4R失活的细胞中,LCN2不能直接诱导激活cAMP;(5)已知的LCN2的另外两种受体(LRP2和24P3R)均不能够在下丘脑细胞中表达。并发现,在小鼠下丘脑细胞中LCN2不能诱导AMP依赖的蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)或酪氨酸激酶的磷酸化,只能够激活cAMP发挥作用。因此可证明,成骨细胞分泌的LCN2能够穿过血脑屏障,与下丘脑中的MC4R结合,并激活该食欲调控通道,抑制食欲,控制体重。
下丘脑LCN2-MC4R-cAMP食欲控制通道
成骨细胞分泌的LCN2经血脑屏障进入下丘脑,在下丘脑室旁核(paraventricular nucleus of hypothalamus,PVN)中,与MC4R结合,可引起Ca2+内流并激活cAMP,促进促甲状腺素释放激素(thyrotropin-releasing hormone,TRH)、促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)等的合成分泌,两者一方面作为“饥饿效应因子”,可以作用于下丘脑引起饱腹感,从而降低食欲及减少摄食,另一方面可通过下丘脑—垂体—肾上腺轴或甲状腺轴,协同促进能量代谢,特别是糖代谢和脂代谢的能量变化,促进糖原储存及脂肪分解和控制体重;Sim1基因蛋白(single-minded homolog 1,Sim1),作为中枢神经系统发育的关键因子及脂代谢过程中核转录因子,可以通过神经系统调节调控动物的摄食量。大量动物实验发现,与正常小鼠相比,Sim1杂合缺失小鼠下丘脑内神经细胞显著减少,摄食量显著提高,表现为肥胖症状;同时Sim1表达量降低也会导致肥胖。
成骨细胞分泌LCN2经血脑屏障进入下丘脑,在下丘脑腹内侧核(ventromedial nucleus of hypothalamus,VMH)中,与下丘脑上的MC4R结合,激活cAMP,可刺激脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的合成,调控能量代谢。虽然BDNF的研究主要集中于神经性疾病,但在动物实验和人群研究中以证实,BDNF在调节体重方面发挥重要作用,BDNF杂合子缺失小鼠表现出慢性摄食量增加,体重增加;并且对糖尿病小鼠外源性给予BDNF能够降低食欲、增加能量消耗和减轻体重,改善高胰岛素和高血糖症的作用(图 2)。
研究表明,生长期小鼠运动不足会出现骨代谢及能量代谢紊乱的现象,表现为骨密度降低及体脂率增加。运动能够对这一现象进行调控,可以改善骨代谢,促进成骨细胞增殖,改善骨密度,减轻体重。近年邹军等结合国内外研究制定了针对骨质疏松的预防及治疗方案,主要以有氧运动和传统养生锻炼为主,低强度抗阻训练为辅。运动对机体骨代谢的调节作用较机械应力刺激对离体细胞更为复杂,运动对骨代谢的调节,不仅造成一定的机械应力作用于骨细胞,而且对各个系统均产生作用,协同调节骨代谢的平衡,确切机制有待于更深入的研究。
Rucci等在成骨细胞离体实验中进行模拟微重力发现,运动能够上调成骨细胞中LCN2表达,推测LCN2是一种新型的成骨细胞机械响应基因,它的调控可能是骨骼组织对低机械力病理反应的中心。
运动对摄食活动有着显著的影响,但不同强度的运动对食欲的影响并不一致。在一次性小强度短时间的运动,摄食活动增强,同时机体内促食欲神经肽升高,但随着运动时间的延长或运动强度的增大,机体内厌食欲神经肽的水平也会升高,因此会出现运动后摄食活动下降的现象。而在长期大强度运动过程中和结束后,机体内厌食欲神经肽一直保持较高水平,机体出现摄食减少和体重下降的现象。成骨细胞分泌的LCN2作为一厌食因子,在其中是否发挥作用,目前尚未报道,有待进一步实验验证。
骨骼是仅次于骨骼肌的较大的内分泌器官。虽然人类对骨的内分泌作用认识较晚,但是对其内分泌功能的研究具有深远的意义。骨内分泌功能紊乱可能会导致其参与的运动及全身性疾病的发生。因此,深入研究骨内分泌功能,对于骨代谢甚至全身代谢,以及运动系统及相关全身性疾病的发病机制等具有重要意义。尤其成骨细胞分泌LCN2可以作用于下丘脑MC4R抑制食欲、调节能量代谢及控制体重,未来或许可在临床上为肥胖及糖尿病治疗提供新靶点。运动能够调节骨源性因子的表达虽有文献报道,但LCN2的运动调节机制有待进一步研究;其研究成果或许可为控制体重的运动调节机制提供新思路。