骨质疏松症治疗新进展:从分子机制到药物靶点
来源:CSOBMR 发布日期:2019-06-13 11:20:37浏览:14624次
作者:董冰子 孙晓方
单位:青岛大学附属医院 内分泌和代谢性疾病科
摘要:骨质疏松症是以骨量减低、骨组织微细结构破坏导致骨脆性增加、骨折风险升高的全身性骨病。正常的骨代谢依赖于成骨细胞介导的骨形成和破骨细胞调节的骨吸收作用平衡。当骨形成减低、骨吸收亢进时,骨代谢失衡引起骨量丢失。Wnt/β-catenin、RANKL/RANK/OPG等通路是参与骨代谢调节的重要通路,也是各类抗骨质疏松药物的作用靶点。目前骨质疏松的治疗药物通过作用于这些通路的关键靶点,调节成骨细胞和/或破骨细胞分化、成熟及其功能,发挥促进骨形成、抑制骨吸收的作用。抗骨质疏松药物的选择需综合考虑其对骨密度、骨转换、骨组织微细结构、药物不良反应及对机体代谢环境的影响等因素。本文旨在总结目前临床应用的抗骨质疏松药物的分子作用机制,通过对骨形成和骨吸收的不同影响,以及对其他组织的作用,探讨各类抗骨质疏松新药的作用特点,以期为骨质疏松症的临床应用治疗提供指导。
关键词:骨质疏松症;骨吸收;骨形成;破骨细胞;钙敏感受体
骨质疏松症(osteoporosis,OP)是指由于骨量低下、骨微细结构破坏导致骨组织脆性增加、骨强度减低,骨折风险增高为特征的全身性骨病。其中骨强度由骨密度(bone mineral density,BMD)和骨质量两个因素决定,后者包括骨组织的细微构造、骨转换、矿化程度等。
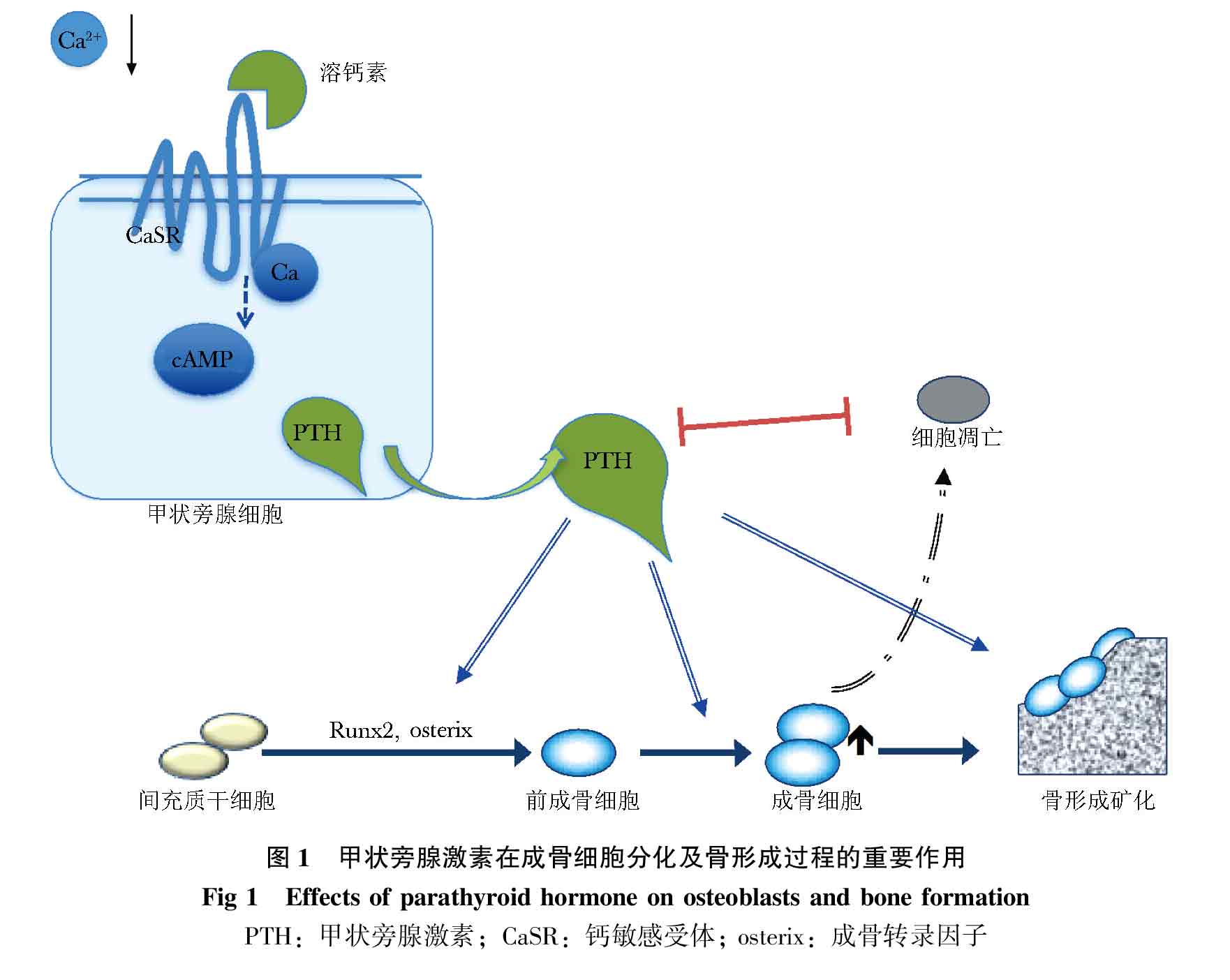
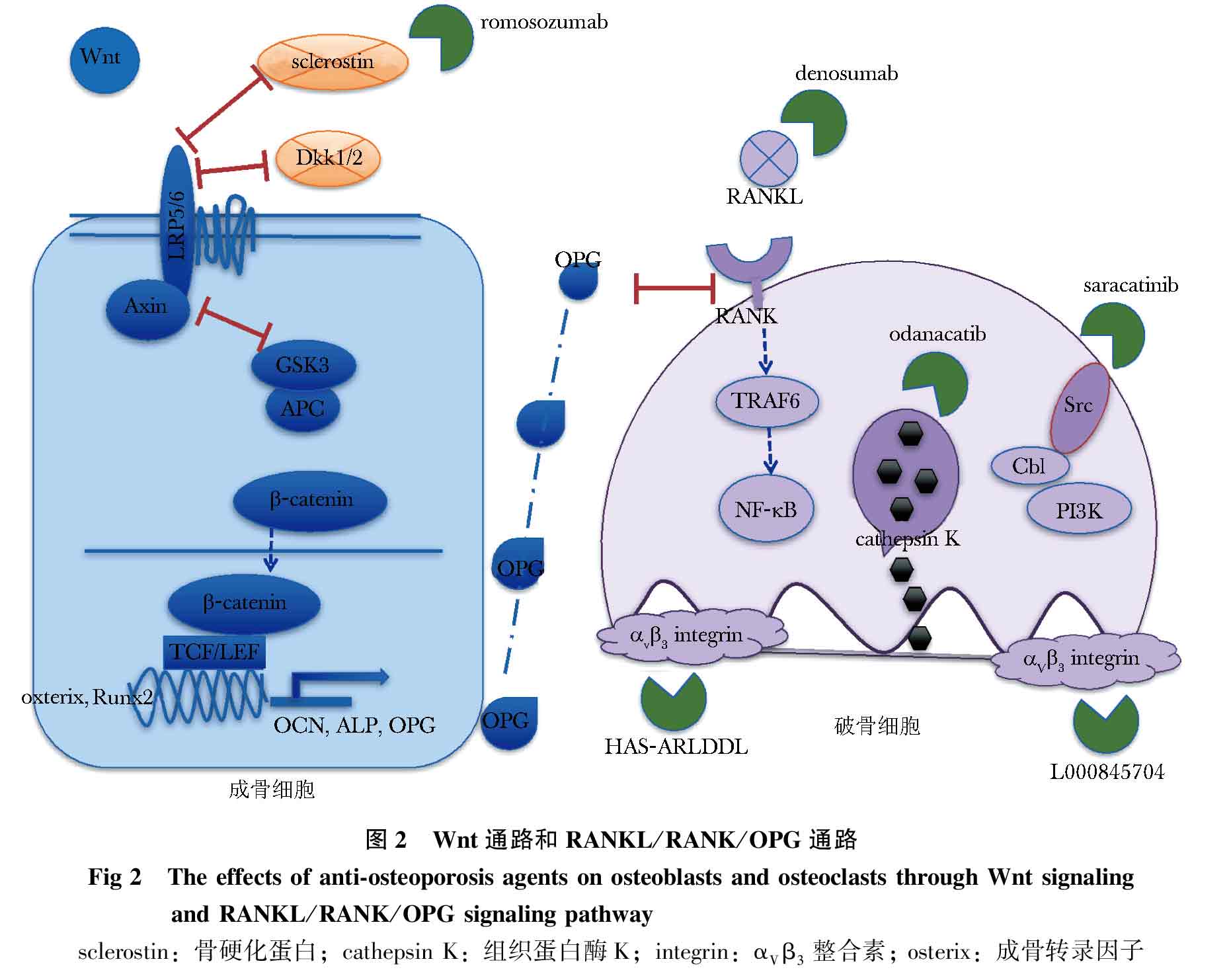
成骨细胞作用下的骨形成和破骨细胞介导的骨吸收保持动态平衡并不断更新,这一过程称为骨重建,保证了骨组织的不断更新和损伤后修复。当这一平衡被打破,骨吸收作用大于骨形成时则引起骨量丢失,骨质疏松随之发生。其分子调控机制受遗传基因、转录因子、信号通路、激素水平、细胞因子等多种因素影响。骨代谢调节的分子机制非常复杂,其中钙磷代谢和甲状旁腺激素(parathyroid hormone,PTH)(图 1)、Wnt/β-catenin、RANKL/RANK/OPG等通路在骨形成—吸收过程中起重要作用。Wnt/β-catenin通路是调节成骨细胞分化、成熟和功能的经典通路(图 2)。Wnt蛋白与LRP5/6受体结合,激活下游β-catenin进入细胞核内,启动成骨关键调节转录因子Runx2、osterix等表达,促进成骨细胞分化和骨形成。而Wnt通路抑制剂如sclerostin、dickkopf(Dkk1/2)等均对骨形成有抑制作用。核因子κB受体活化因子(receptor activator of NF-κB,RANK)及其配体(RANK ligand,RANKL)结合通过激活下游NF-κB、p38 kinase、N-terminal kinase JNK通路,在破骨细胞的分化、活化过程中起到关键作用(图 2)。成骨细胞分泌的护骨素(osteoprotegerin,OPG)与RANKL结合,减少RANKL/RANK结合率从而干扰破骨细胞的分泌,因此RANKL/OPG的比例影响骨吸收速率,并受PTH、1, 25(OH)2D3、细胞因子等多种因素调节。以上多种因素共同参与骨代谢的调节,通路中的关键蛋白、转录因子、配体和抑制剂等是抗骨质疏松治疗药物的潜在靶点。
抗骨质疏松治疗药物大致可分为骨吸收抑制剂、骨形成促进剂和骨代谢调节药物。近年,抗骨质疏松新药取得了很大进展,如骨吸收抑制剂包括RANKL的中和性抗体狄诺塞麦(denosumab)、硬化蛋白(sclerostin)的单克隆抗体romosozumab,组织蛋白酶K(cathepsin K)抑制剂奥达卡替(odanacatib)等及骨形成促进剂PTH类似物abaloparatide、钙敏感受体拮抗剂溶钙素(calcilytics)等,以及药物的联合或交替应用。本文针对不同抗骨质疏松治疗药物的分子机制和作用通路进行综述。
PTH及其类似物
PTH是含84个氨基酸的多肽,可促进间充质干细胞向成骨细胞方向分化、减少成骨细胞凋亡,同时促进破骨细胞的生成和活性。PTH对骨代谢的作用呈双相调节,其促进骨形成的作用依赖于高振幅-短脉冲的水平波动,在治疗最初的6~12个月作用最强,称之为“合成时间窗”(anabolic window)。短期或间断PTH注射可明显刺激成骨细胞介导的骨形成,对于皮质骨的作用较海绵骨更为明显。然而,持续性的高PTH水平,如甲状旁腺功能亢进时,则会过度刺激破骨细胞活性、增加骨吸收,导致净骨量丢失,且易引起高钙血症。PTH可增加骨转换速率,对骨形成的促进作用大于骨吸收时促进骨的合成,然而其对骨形成或骨吸收作用占主导地位的调节机制复杂,值得进一步研究。
特立帕肽(teriparatide,PTH1-34)是PTH的活性片段,对于绝经后骨质疏松患者可显著增加骨密度,使椎体骨、股骨的骨折风险分别降低65%和53%,并可加速骨折后的修复愈合。特立帕肽与其他骨吸收抑制剂联用效果更为显著。DATA试验联合应用特立帕肽和狄诺塞麦可一定程度抵消长期使用特立帕肽带来的骨吸收作用,联合治疗组显著增加BMD。特立帕肽与双膦酸盐类药物阿仑膦酸钠的联合治疗BMD显著增加,同时可改善双膦酸盐类药物对骨转换水平的过度抑制,取得了令人瞩目的成绩。
PTH在大鼠实验中有致骨肉瘤发生的可能,然而在长期临床观察中罕有骨肉瘤发生率增加的报道。与人类不同,啮齿类动物的骨组织在成骨作用刺激下可以不断生长,这可能是实验大鼠发生骨肉瘤的潜在原因。然而,长期使用特立帕肽可能引起血钙水平波动、尿钙排泄增加、尿路结石,甚至肾功能不全等。此外,特立帕肽虽然增加BMD,但由于其对皮质骨厚度和多孔化的影响,其骨微细结构及组织形态学的变化尚待进一步探讨。
Abaloparatide是PTH相关蛋白(PTHrP)类似物,选择性激动表达于成骨细胞和骨细胞的PTH受体(PTH1R),激活下游cAMP信号通路,促进成骨作用。在卵巢切除(ovariectomized,OVX)的骨质疏松大鼠模型中,增加皮质骨及海绵骨量,并增加骨强度,骨形成标志物水平升高,而不影响血钙水平、骨吸收指标及皮质骨多孔化。临床试验亦证实abaloparatide显著增加BMD,降低非椎体骨骨折发生率,且高钙血症发生率低于特立帕肽(abaloparatide 3.4% vs teriparatide 6.4%)。今后期待更多abaloparatide与其他药物的疗效比较及联合治疗效果的临床报道。
钙敏感受体拮抗剂:溶钙素
钙敏感受体(calcium-sensing receptor,CaSR)属于G蛋白偶联受体超家族,表达于甲状旁腺、肾脏、胃肠道、骨组织等,参与调节PTH的分泌、肾脏钙的排泄,以及消化道钙的吸收,对维持体内钙平衡起重要调节作用。甲状旁腺主细胞上的CaSR感受细胞外Ca2+浓度,通过下游PLC-PKC信号传递,调节内源性PTH的释放。此外,CaSR表达于成骨细胞、破骨细胞,直接参与调节骨形成。溶钙素是钙敏感受体的拮抗剂,与CaSR跨膜区结合阻断下游通路,模拟低钙血症状态,刺激内源性PTH迅速释放,从而促进骨形成(图 1)。
动物实验证实溶钙素MK-5442可提高小鼠的BMD及骨转换水平。然而它在对绝经后骨质疏松患者的Ⅱ期临床试验却未取得满意的效果,但这一结果可能是由于MK-5442半衰期较长,使体内内源性PTH持续性的过多分泌,过分刺激骨吸收从而削弱了成骨作用,因此推论其他半衰期较短的同类药物在理论上可以促进PTH的迅速而短暂的释放,减少过长时间的PTH水平升高,促进骨形成,避免过分激活骨吸收。因溶钙素类药物口服吸收利用率好,且避免皮下注射的疼痛,价格更为低廉,故有良好的临床应用前景。
硬化蛋白抗体
硬化蛋白由SOST基因编码,特异性表达于成熟的骨细胞,通过结合LRP5/6受体抑制Wnt/β-catenin通路(图 2)减少成骨作用,并可作用于邻近骨细胞,上调RANKL表达及RANKL/OPG比例,刺激破骨细胞介导的骨吸收。其单克隆抗体romosozumab通过抑制硬化蛋白活性,拮抗这一过程,促进骨形成同时减少骨吸收,从而增加BMD。
STRUCTURE研究证实rosomozumab皮下注射12个月治疗绝经后骨质疏松女性,显著降低椎体骨折发生率(rosomozumab组0.5%,安慰剂组1.8%,P<0.001),在治疗初期增加血清骨形成标志物,并持续性降低骨吸收标志物,显著降低新发骨折的风险和骨折发生率。rosomozumab使BMD增加的程度稍弱于特立帕肽,但高钙血症、关节痛等不良反应发生率明显降低。
由于硬化蛋白仅由成熟的骨细胞分泌,其表达的组织特异性很强,硬化蛋白的单克隆抗体romosozumab可以更好的特异性作用于骨组织,对其他组织器官的影响较小,故药物安全性和耐受性较好。这也是硬化蛋白的单克隆抗体romosozumab相比较其他Wnt通路抑制剂的抗体(如Dkk1、Dkk2抗体)效果及安全性更优的重要原因。
RANKL抗体:狄诺塞麦
狄诺塞麦是RANKL的单克隆抗体,干扰RANKL与其受体RANK的结合,特异性的抑制破骨细胞的分化和成熟。大型多中心的FREEDOM临床试验中,狄诺塞麦可显著减少椎体骨、非椎体骨及髋部骨折的风险,特别是以骨吸收作用增强为突出特征的高龄绝经后女性,并且在长期的临床观察中其安全性充分得到证实。
恶性肿瘤骨转移相关的骨质疏松主要是以破骨细胞活性增强、骨吸收增加为特点,RANKL在这一病理过程中起重要作用。狄诺塞麦用于前列腺癌去势治疗患者的临床研究证实,在治疗开始后即表现出对骨量丢失的保护作用,治疗24个月可增加5.6%椎体BMD,治疗36个月显著降低新发椎体骨折风险。狄诺塞麦针对其他恶性肿瘤如乳腺癌骨转移引起的骨量减低亦有良好的治疗效果,今后期待更多对其他恶性肿瘤相关骨质疏松治疗效果的临床研究。
除调节骨代谢外,RANKL/RANK/OPG通路也在胰岛细胞调节中起重要作用。狄诺塞麦阻断RANKL通路可通过抑制下游激酶GSK3并上调CREB蛋白表达,改善胰岛素抵抗、促进胰岛β细胞增殖,且可使骨钙素(osteocalcin,OCN)水平升高,而OCN可参与改善糖耐量、增加胰岛素敏感性、改善胰岛β细胞功能,所以狄诺塞麦在一定程度上可改善患者的血糖水平及胰岛素抵抗,特别适用于合并糖尿病的骨质疏松症患者,对此结果期待大规模的临床试验结果。
组织蛋白酶K抑制剂:奥达卡替和丹参酮
组织蛋白酶K由破骨细胞分泌,可降解胶原蛋白,促进破骨细胞作用。组织蛋白酶K抑制剂奥达卡替可抑制破骨细胞的生成及功能,但并不影响破骨细胞的分化及数量,亦不影响成骨细胞作用,通过减少骨吸收而增加BMD,故适用于破骨细胞作用增强、骨吸收亢进为主的骨质疏松类型。绝经后女性连续服用奥达卡替50 mg每周1次可使椎体和髋部BMD显著增加,同时明显抑制骨吸收标志物,而不影响骨形成标志物水平,以减少骨转换降低引起的不良反应。然而,长期临床观察中,不良反应如皮肤纤维化、心脑血管事件有报道,LOFT研究证实脑血管事件的发生率有所升高(odanacatib组1.4%,安慰剂组1.1%,HR 1.32,P=0.03),故其安全性仍需长期观察。
我国传统中药丹参酮通过结合到组织蛋白酶K的ectosteric位点,选择性的抑制胶原酶活性,减少胶原蛋白降解。与直接作用于活性位点的奥达卡替相比,丹参酮不影响破骨细胞的数目、生成和功能。模拟绝经后骨质疏松的OVX大鼠动物实验表明,丹参酮对破骨细胞的作用为非雌激素依赖性,消除了雌激素对子宫的效应,且不影响成纤维细胞介导的TGF-β通路,对认知能力无影响。对OVX大鼠治疗3个月,可降低骨吸收标志物,并升高骨形成标志物水平,显著增加BMD,表明丹参酮特异性的作用于cathepsin K的非活性位点,选择性的抑制作用可减少因cathepsin K抑制引起的不良反应,且不依赖于雌激素作用,这一传统中药可能成为抗骨质疏松新药,期待大规模的临床观察。
Src激酶抑制剂:塞卡替尼(saracatinib)
Src激酶在调节破骨细胞功能及活性中扮演着重要角色,Src激酶抑制剂塞卡替尼可抑制破骨细胞的活性,从而减弱骨吸收作用,增加骨量。Ⅰ期临床试验中,塞卡替尼呈剂量依赖性的降低了骨吸收标志物血Ⅰ型胶原C-末端肽交联(C-terminal type Ⅰ collagen crosslinked telopeptide,CTX)和尿Ⅰ型胶原N-末端肽交联(N-terminal type Ⅰ collagen crosslinked telopeptide,NTX)的水平,而不影响骨形成标志物。实验组中皮疹、稀便等症状发生率较安慰剂组略高,未观察到严重的不良反应。
此外,塞卡替尼(saracatinib)已作为治疗乳腺癌、非小细胞肺癌、胰腺癌、前列腺癌等抗肿瘤药物,并可降低恶性肿瘤晚期骨转移患者的血清骨吸收标志物水平。因此,塞卡替尼可作为有前景的抗骨吸收药物,特别针对恶性肿瘤骨转移,治疗原发恶性肿瘤的同时,也减少骨转移相关的骨吸收,一定程度的改善患者生活质量,今后期待Ⅱ、Ⅲ期临床试验的结果。
αVβ3整合素受体拮抗剂
αVβ3整合素(integrin)与破骨细胞表面的整合素受体结合后促进破骨细胞粘附、活化,并在破骨细胞分化过程中起重要作用。阻断αVβ3整合素受体可以减少粘附于骨基质蛋白的破骨细胞数量,阻碍破骨细胞发挥功能从而减少骨吸收。动物实验表明高选择性αVβ3整合素拮抗剂HSA-ARLDDL可以抑制破骨细胞生成,降低骨吸收标志物水平,减少骨量的丢失,且不影响成骨细胞分化和钙沉积。Ⅱ期临床试验表明,αVβ3整合素受体拮抗剂L-000845704可以显著增加椎体BMD,使骨吸收标志物下降42%,大剂量L-000845704亦可有效增加髋骨BMD,可以作为有效的抗骨质疏松新药,期待更多临床疗效观察和安全性评价。
展望
随着对骨质疏松发病机制研究的深入,越来越多的作用机制和靶点被发现,例如Semaphorin-3A通过感觉神经系统调节,既可以抑制破骨细胞作用,又促进成骨细胞活性,雄激素受体调节剂(selective androgen receptor modulator,SARM)通过促进成骨细胞作用、性激素调节组织力学负荷、增加肌量等机制增加BMD,miRNA也在成骨细胞分化及骨形成中发挥重要作用,如miR-214拮抗剂具有骨形成促进作用等。这些尚处于基础研究阶段,有待进一步的临床试验结果和安全性评估。因此,研究针对不同作用靶点的抗骨质疏松新药,更精准地调控骨吸收和骨形成的动态平衡,是治疗骨质疏松症的有效途径。