膝骨性关节炎患者胫骨软骨和软骨下骨ERK1/2信号蛋白表达
来源:CSOBMR 发布日期:2019-04-01 16:59:38浏览:10546次
作者:赵晋 谢燕燕 闫振宇 张立智
单位:
1、华北理工大学附属医院血液内科
2、同济大学附属杨浦医院骨科
摘要:目的 观察膝骨性关节炎(osteoarthritis,OA)患者胫骨平台硬化区与非硬化区软骨和软骨下骨细胞外调节蛋白激酶(extracellular signal-regulated kinase 1/2, ERK1/2)信号蛋白的改变,探讨OA的发病机制。方法 收集OA患者行全膝关节置换术后遗弃的胫骨平台组织(n=22),大体观察后,通过硬组织甲苯胺蓝染色证实并区分硬化与非硬化区软骨和软骨下骨观察病理结构改变,分离硬化与非硬化区的软骨与软骨下骨组织,通过Western blot法分别测定硬化区(n=22)与非硬化区(n=18)软骨及软骨下骨ERK1/2总蛋白以及磷酸化蛋白的表达。结果 OA患者膝关节胫骨平台硬组织甲苯胺蓝染色观察显示,硬化区软骨层变薄、纤维化、局部可有断裂,形成深达软骨下骨的微裂隙,软骨细胞减少且层次不清排列欠佳,软骨下骨骨小梁厚度增加。OA胫骨平台硬化区的软骨及软骨下骨分别与非硬化区相比ERK1/2总蛋白表达量无明显差异(t=1.92,P=0.062;t=1.75,P=0.088),但硬化区软骨及软骨下骨ERK1/2磷酸化蛋白分别明显高于非硬化区,差异有统计学意义(t=15.04,P<0.001;t=20.37,P<0.001)。结论 OA硬化区软骨和软骨下骨ERK1/2信号蛋白不同于非硬化区,硬化区软骨和软骨下骨ERK1/2蛋白磷酸化增强可能是其微结构病变的重要原因之一。
关键词:骨性关节炎;软骨;软骨下骨;胞外信号调节激酶1/2信号蛋白
骨性关节炎(osteoarthritis,OA)是一种以软骨和软骨下骨发生进行性退变为特征的关节疾病。前期的调查研究提出,尽管不同患者膝OA关节内最初受到损伤的组织可能不同,其中损伤或退变的机制可能也存在差异,但在异常的应力和生物学作用下,患者进行性的出现了以软骨退变、软骨下骨硬化为特征的病理变化,而且这种变化可继续进展直至整个关节。软骨下骨和软骨是关节内应力和生物学作用的主要载体,目前由于对OA病变进展中骨和软骨不同病变部位或病变阶段的认识不足,尚无有效的方法阻止OA疾病的进展。
在整个关节完全发生病变之前,同一OA患者关节内存在不同部位的病变程度不同,针对关节内相对正常的结构和已经病变结构的区别进行研究,有利于对OA病变进展进行研究,膝关节置换术后遗弃的标本为该研究提供了良好的素材。根据同一关节内病变程度和进展阶段不同,既往研究将软骨下骨分为病变的硬化区和没有明显病变的非硬化区。笔者前期的研究也显示,硬化区软骨下骨的成骨细胞表型不同于非硬化区。同一OA患者关节内不同部位的同一组织具有高度相似性,是否存在异常的信号通路改变了硬化区的细胞生物学表型, 值得进一步研究。
软骨下骨和软骨构成了一个复合体,共同促进了OA病变的进展,探索均能导致或促进两者病变的共同的信号通路,对今后调控和阻止疾病进展可能有重要的作用。胞外信号调节激酶(extracellular signal-regulated kinase,ERK1/2)是丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)家族的一员,对骨和软骨正常生长发育和代谢有着重要的调控作用,维持了关节的健康和平衡。笔者前期对OA软骨下骨和软骨之间信号通路进行的初步调查研究显示,ERK1/2不仅参与了OA软骨下骨和软骨的病变,还可能在OA骨软骨之间的信息交流中起着重要作用。本文对人膝OA胫骨平台硬化区与非硬化区软骨和软骨下骨组织的ERK1/2总蛋白以及磷酸化蛋白的表达进行研究,探讨OA硬化区软骨下骨和软骨的发病机制,以期为阻断OA进展,为OA早期诊断及治疗提供新的研究方法和思路。
材料与方法
实验标本收集
征得患者同意后,留取2016年1至4月OA患者关节置换术后遗弃的胫骨平台组,其中2例由于骨组织破坏严重而遗弃。共收集22例OA患者的胫骨平台组织,其中男性9例,女性13例;年龄58~79岁,平均年龄68.9岁;病程10~26年。
临床纳入标准
参考中华医学会骨科分会《骨关节炎诊治指南(2007版)》,在排除类风湿关节炎、肿瘤性疾病及创伤等疾病的情况下,符合(1)+(2)条或(1)+(3)+(5)+(6)条或(1)+(4)+(5)+(6)条,即可诊断为膝OA。(1)近1个月内反复膝关节疼痛;(2)X线片(站立或负重位)示关节间隙变窄、软骨下骨硬化和(或)囊性变、关节缘骨赘形成;(3)关节液(至少两次)清凉、黏稠,WBC<2 000个/mL;(4)中老年患者(≥40岁);(5)晨僵≤30 min;(6)活动时有骨摩擦音(感)。
方法
软骨及软骨下骨的微结构改变:(1)术后获得新鲜胫骨平台标本后,观察其大体情况,在显微镜下仔细检查骨小梁和软骨区分硬化与非硬化的软骨下骨:硬化区软骨下骨板厚度大于2 mm,可见裸露软骨下骨或其覆盖薄层纤维软骨;非硬化区软骨下骨板最多1 mm,且覆盖正常完整的软骨。(2)不脱钙骨组织甲苯胺蓝染色:新鲜骨软骨组织块,经过组织固定、脱水和包埋,在AW100测量系统控制下,组织切片厚度为5~10 μm。将体积分数1%甲苯胺蓝染色液直接滴加于切片表面,干燥后封固,光学显微镜下观察标本组织形态。
Western blot法检测软骨和软骨下骨中ERK1/2信号蛋白的改变:(1)软骨、软骨下骨分离及提取蛋白:在无菌条件下,将患者膝关节胫骨平台硬化区和非硬化区块状骨软骨组织(直径约10 mm、厚8 mm),分离并剪成碎块状,用灭菌的锤将软骨下骨击打成碎块,分别迅速于盛有液氮的研钵中研磨成匀浆粉状收集到1.5 mL的EP管中。各EP管加入1 mL RIPA强蛋白裂解液(含胃蛋白酶抑制剂、亮抑蛋白酶肽等、胰蛋白酶抑制剂等及磷酸酶抑制剂),放置冰上裂解10 min后并匀浆90 min。4 ℃、12 000 r/min离心30 min,提取上清液,分装于EP管中,-80 ℃保存。(2)BCA蛋白定量法测定蛋白浓度:按试剂盒说明用RIPA强蛋白裂解液稀释BSA标准品,并按BCA-A:BCA-B=50:1的体积比配制BCA工作液;将稀释好的标准品及待测样品分别用移液器取25 μL加到96孔板中,每个样品做3个平行反应;每孔加200 μL工作液,充分混匀,此过程注意产生气泡影响结果的准确性;将96孔板于37 ℃下孵育30 min,冷却至室温后在3~5 min钟内用酶标仪在562 nm处测定各样品及标准品吸光度,并绘制标准曲线计算样品蛋白浓度。(3)蛋白质变性:将各样品于EP管中加RIPA裂解液配至等体积,与2×还原型SDS-PAGE上样缓冲液按1:1等体积混匀,100 ℃下金属浴10 min使蛋白质变性。(4)行SDS-PAGE电泳分离蛋白:①配胶:取出SDS-PAGE凝胶制备试剂盒配置12%的分离胶和5%的浓缩胶。先从玻璃板一侧灌入分离胶至距固定板上缘1 cm的位置,后加纯水至玻璃板上缘赶走气泡,约30 min后辅助应用滤纸将水吸干,待晾干后加入浓缩胶缓冲液,选适宜的梳子自一侧插入浓缩胶,约30 min后凝固备用。②将自两侧梳子缓慢取下向胶板置于电泳槽中固定,于槽中间加满新配制的电泳缓冲液。③上样:每个孔上样15 μg的样品,同时在一个上样孔中加5 μL预染彩虹蛋白marker。④电泳:恒压80 V,待溴酚蓝至分离胶和浓缩胶交界时将电压提高至100 V,直至溴酚蓝达胶板底部时停止电泳。⑤转膜:将凝胶、NC膜1张及滤纸4张浸入转膜缓冲液中10 min,于转膜夹中从负极开始,依次将海棉垫、滤纸、胶、膜、滤纸、海绵垫重叠好,放入转膜仪内,恒流250 mA,60 min进行转膜。⑥裁膜:将膜浸入丽春红染色液中摇动,约1 min后根据marker确定目的条带进行裁剪。⑦封闭:室温下将膜浸入封闭液中,于摇床上缓慢摇动约1~2 h,注意封闭液应将膜全部覆盖,后用新配制的TBST缓冲液洗涤。⑧一抗孵育:用5 mL抗体稀释液稀释一抗至适宜浓度(GAPDH稀释比1:2 000,ERK抗体及p-ERK抗体稀释比1:1 000),将目的条带膜蛋白向下置于一抗稀释液中,4 ℃下摇床过夜。⑨二抗孵育:TBST缓冲液于摇床洗条带,共5次,每次5 min,将辣根过氧化物酶标记的IgG二抗至适当浓度(1:2 000),将已经洗好的目的条带膜蛋白向下置于避光抗体孵育盒内,室温孵育约1~2 h,TBST冲洗3次,每次5 min。⑩ECL化学发光显影:取等量A液和B液混匀,均匀滴加在在蛋白条带上,确保工作液覆盖整张膜,室温孵育3~5 min。⑪曝光成像:用Image Lab图像分析软件检测取目的条带校正后的灰度值,用目的条带与内参的比值与进行标准化。
统计学方法
采用SPSS17.0统计软件对实验数据进行统计分析,实验数据为计量资料,均采用(x±s)表示,组间采用独立样本t检验。P<0.05为差异有统计学意义。
结果
大体观察
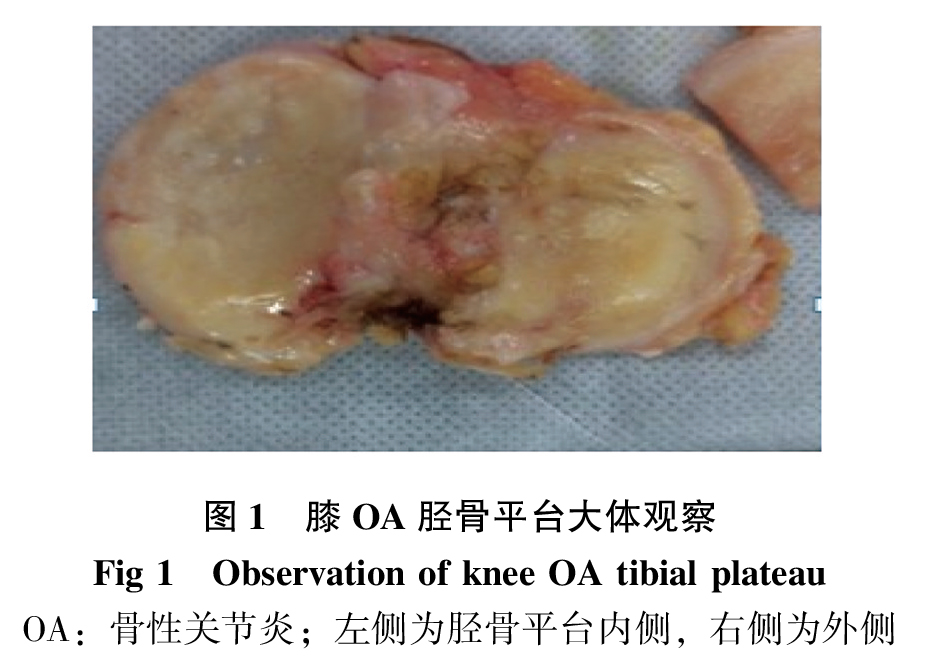
OA患者胫骨平台内侧软骨的退变较外侧严重,内侧胫骨平台软骨表面更粗糙有磨损,呈灰白色,欠光泽,局部软骨缺失,可见裸露、钙化的软骨下骨,胫骨平台边缘有骨赘形成。外侧胫骨平台软骨表面较光滑,富有光泽,部分呈黄色,未见溃疡及软骨脱落,边缘可见骨赘形成(图 1)。
组织病理学观察
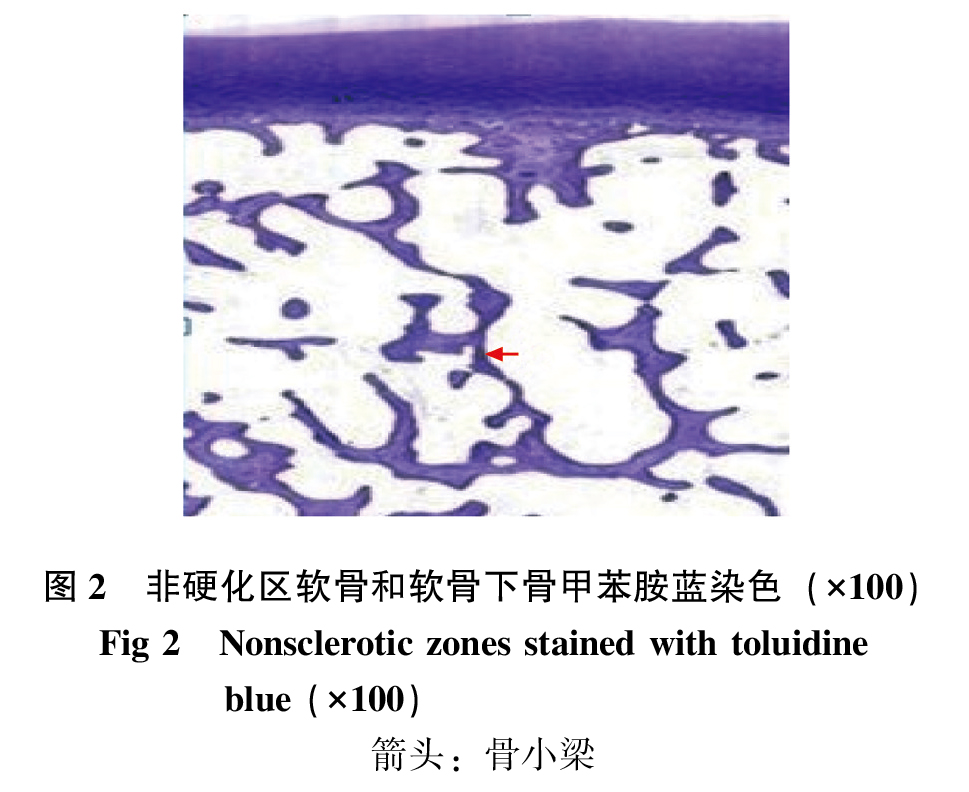
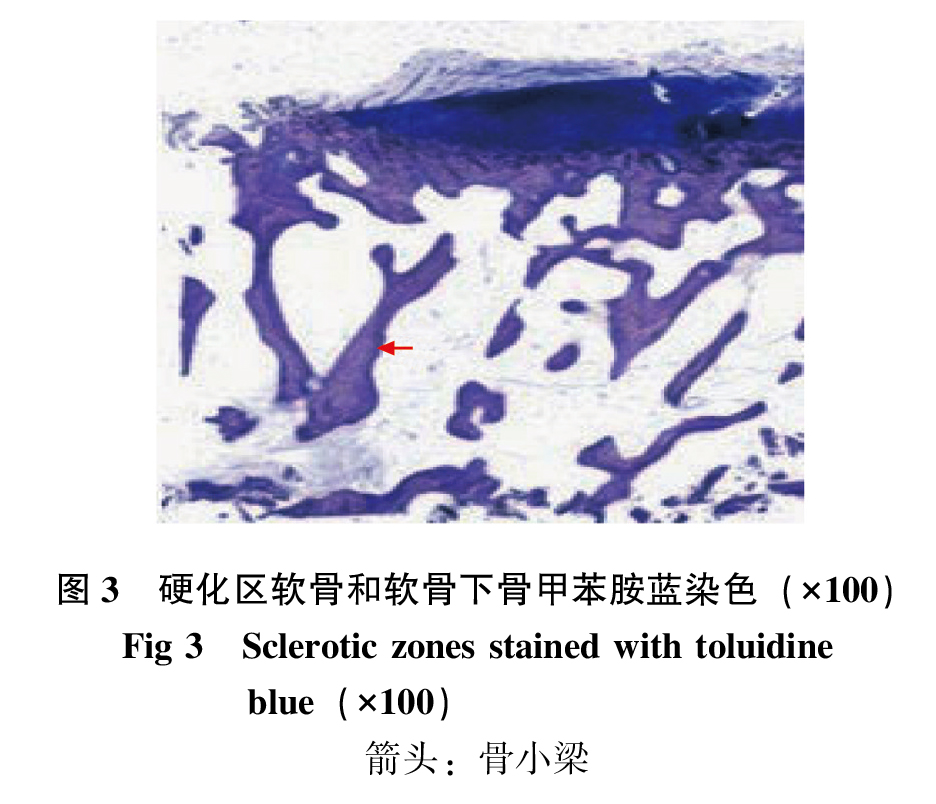
甲苯胺蓝染色显示非硬化区软骨成深蓝色,软骨下骨呈淡蓝色,细胞层次分明,排列有序,细胞外基质染色均匀(图 2);硬化区软骨染色不均匀且部分失染,表面有破坏,软骨层变薄,纤维化、局部可有断裂,形成深达软骨下骨的裂隙,软骨细胞减少且层次不清排列欠佳(图 3)。硬化区软骨下骨骨小梁增粗,软骨下方钙化软骨层和软骨下骨的骨小梁明显增厚,与非硬化区骨小梁排列不同(图 3)。
Western blot法测定ERK1/2信号蛋白结果
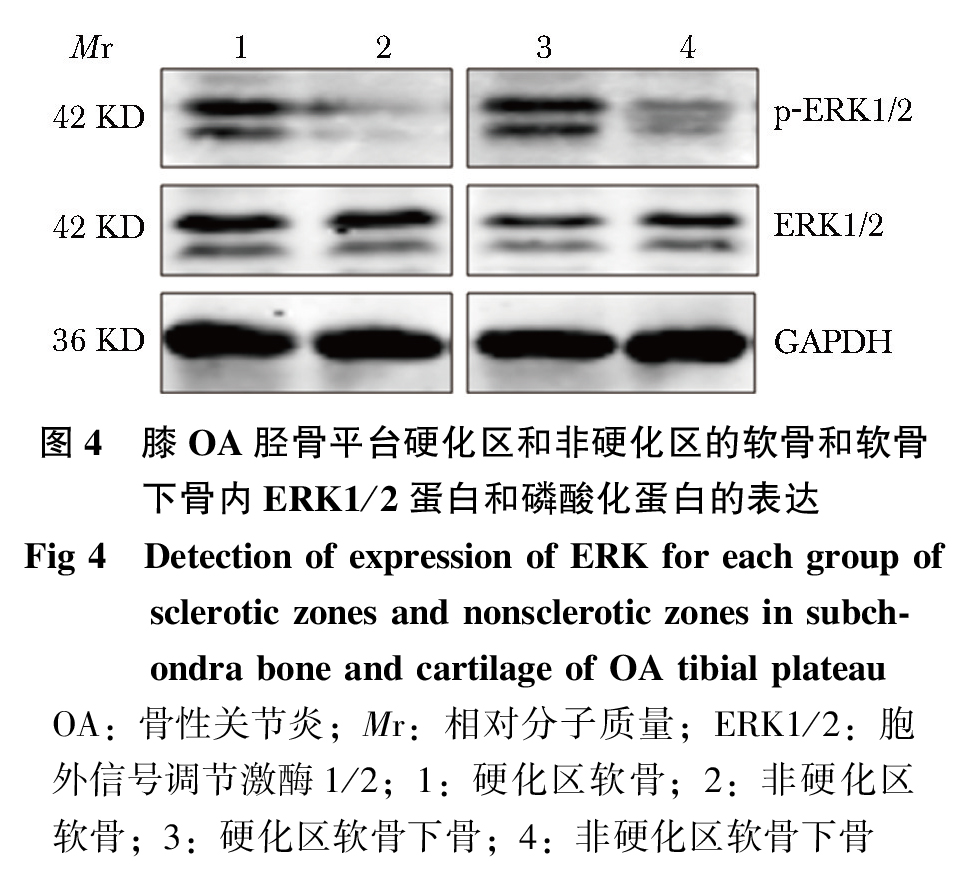
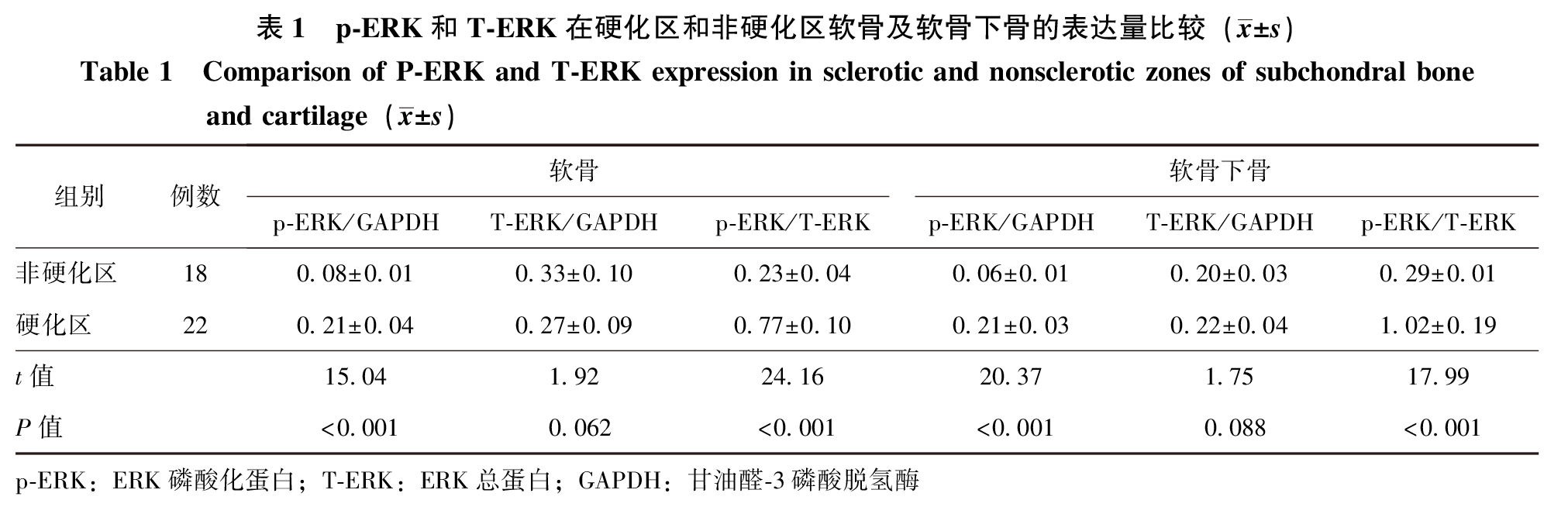
膝OA胫骨平台硬化区软骨和软骨下骨分别同非硬化区软骨和软骨下骨相比,ERK1/2总蛋白表达量无明显差异(P>0.05),硬化区软骨和软骨下骨ERK1/2蛋白磷酸化明显高于非硬化区(P<0.05),硬化区软骨及软骨下骨ERK1/2蛋白激活增加(图 4及表 1)。
讨论
OA是以软骨退变,软骨下骨重塑为主要特征的整个关节退行性病变。软骨下骨和软骨作为关节的基本单位,两者在结构上相互支撑,密不可分。两者还通过应力和生物学上的联系,共同维持关节的结构和功能。本实验采用硬组织切片联合应用甲苯胺蓝染色的方法对软骨及软骨下骨微结构进行组织病理学观察,可不失真地观察骨和软骨组织标本。染色结果示硬化区染色不均匀且部分失染,软骨表面破坏,软骨层纤维样改变,软骨细胞减少且层次不清排列欠佳,形成深达软骨下骨的裂隙;软骨下骨骨小梁较非硬化区增粗、增厚。本研究中的大体形态观察和病理切片研究显示,硬化区软骨和软骨下骨的结构均不同于非硬化区软骨下骨。本实验关注这些骨软骨结构病变区,探索是否存在与两者病变发生有关的共同的异常信号通路。
ERK途径对骨和软骨正常生长、发育和代谢有着重要的调控作用,维持着关节的健康和平衡。蛋白激酶的磷酸化水平可以反映激酶的活化水平。活化的ERK转移到胞核而磷酸化核内相关底物如转录因子c-fos、c-Jun、Elk-1、c-myc和ATF2等,从而参与细胞增殖与分化的调控。ERKs可磷酸化胞浆内的细胞骨架成分,如微管相关蛋白(microtubule-associated protein,MAP)-1、MAP-2和MAP-4,参与细胞形态的调节及细胞骨架的重分布。研究发现,适当的应力能活化p42/p44MAPK,使成骨细胞参与对骨结构进行重塑以适应生理和应力的需要。低强度脉冲超声波能刺激钙离子内流,活化ERK和p38,通过CCN2,促进Ⅱ型胶原(type Ⅱ collagen,COL2a1)和聚蛋白多糖(Aggrecan,ACAN)的表达,有利于关节软骨的再生。然而,过度的应力或应激刺激、细菌产物、炎症介质等也可引起ERK1/2通路的激活,ERK1/2通路的激活与炎症反应有着密切关系。如IL-1β通过激活ERK磷酸化,促进骨关节炎的发生和发展。因此,不同的信号激活途径,被激活细胞的种类,ERK通路的下游信号的活化方向,决定着ERK信号通路的调控方向。
本实验显示不论在硬化区和非硬化区,不论是在软骨还是在软骨下骨ERK总量相等,然而磷酸化水平不同,硬化区的软骨和软骨下骨的ERK1/2活化和磷酸化水平更高。ERK的激活可能调节了软骨细胞肥大分化以及软骨基质降解,加重软骨退变。研究表明在OA软骨细胞中,ERK1/2通路表达上调与肥大软骨细胞标志物如Ⅹ型胶原、碱性磷酸酶以及MMP13等的表达增加密切相关,不仅造成软骨合成代谢降低,同时也可影响软骨基质的稳定性。ERK通路不仅对软骨细胞有调节作用,有学者通过对成骨细胞体外培养发现ERK1/2通路可通过磷酸化转录因子Runt相关转录因子2(runt-related transcription factor2, Runx2)以及活化转录因子4(activating transcription factor 4,ATF4)介导成骨细胞早期和晚期分化过程。ERK活化还能增强Mitf核转运,上调下游与破骨细胞活化有关的目的基因表达。本实验对人软骨下骨和软骨组织的研究更能反映人OA真实的病变,硬化区和非硬化区组织均取材于同一膝OA胫骨平台,而硬化区软骨和软骨下骨ERK1/2信号蛋白磷酸化均明显增强,提示ERK1/2参与了软骨和软骨下骨两者的病变进展过程。
研究还显示,ERK1/2通路参与了OA软骨下骨和软骨间异常的信息交流,这可进一步促进OA的恶性进展。关节软骨和软骨下骨之间可以通过激活ERK1/2信号调节血小板结合蛋白基序的解聚蛋白样金属蛋白酶(a disintegrin and metallo-protein-ase with thrombospondin motifs,ADAMTs)和基质金属蛋白酶(matrix metalloproteinase,MMPs)的释放,降解软骨基质,促进共培养的软骨细胞肥大分化。而OA软骨细胞可通过ERK1/2通路增强成骨细胞标记物如Runx 2、碱性磷酸酶以及骨钙素的表达。目前,ERK信号通路是如何启动并促进OA软骨和软骨下骨共同病变的具体作用机制有待进一步研究。
本研究显示,ERK1/2通路高表达于硬化区软骨和软骨下骨组织,与OA的病变紧密相关。既往的研究显示,ERK1/2还可能参与骨和软骨的异常交流和相互作用,促进OA的病变进展。因此,深入地研究OA中ERK导致软骨和软骨下骨病变的共同机制,深入研究ERK激活机制,调控下游细胞信号传导及和其他信号通路间的相互作用,可能为进一步特异的阻断ERK信号通路的恶性循环,为阻断OA发生和发展的研究和治疗提供新的方法和思路。