卵泡刺激素抗体预防骨质疏松和肥胖
来源:CSOBMR 发布日期:2019-02-14 13:56:38浏览:10934次
作者:伍西羽 廖二元 肖业
单位:国家代谢性疾病临床医学研究中心 中南大学代谢内分泌研究所 中南大学湘雅二医院内分泌科
摘要:卵泡刺激素(follicle-stimulating hormone, FSH)抗体阻断FSH与破骨细胞或/和脂肪细胞的FSH受体结合,抑制破骨细胞骨吸收和促进骨形成而预防骨丢失,诱导脂肪细胞线粒体密度增加、白色脂肪米色化和激活棕色脂肪组织产热增加而降低体脂。FSH抗体有望成为同时预防骨质疏松和肥胖的潜在药物。
关键词:卵泡刺激素;卵泡刺激素抗体;骨质疏松;肥胖
卵泡刺激素(follicle-stimulating hormone, FSH),顾名思义,过去认为它只是刺激卵巢卵泡细胞生长发育和雌激素分泌的一种糖蛋白激素。然而,近10年对FSH及其受体在整合生理学中的作用研究发现,围绝经开始的快速骨转换和骨丢失与FSH快速增加有关,FSH也作用于破骨细胞、骨髓间充质干细胞和脂肪细胞。FSH与破骨细胞的FSH受体(FSH receptor, FSHR)结合,促进破骨细胞形成及刺激骨吸收和调节骨量;FSH与骨髓基质干细胞的FSHR结合则下调成骨细胞的数量;采用FSH抗体与FSH结合阻断其生物学作用,则抑制骨吸收和刺激骨形成而预防骨丢失。最新研究发现,FSH与脂肪细胞FSHR结合,激活一系列参与脂质生物合成的基因,介导脂肪组织的合成和蓄积及人类衰老过程中的脂肪代谢障碍,FSH抗体阻断FSH与脂肪细胞FSHR相互作用,则引起白色脂肪组织向棕色/米色脂肪组织转化,以及诱导脂肪细胞线粒体密度增加,激活棕色脂肪组织产热增加而降低体脂。因此,FSH抗体有望成为同时预防骨质疏松和肥胖的潜在药物,为降低骨质疏松性骨折、2型糖尿病和心血管病的患病风险提供新的途径。本文简要介绍FSH抗体增加骨量和降低体脂的基础研究现况。
FSH抗体作用机制
传统的观念认为,FSH仅仅是刺激卵巢分泌雌激素和睾丸分泌雄激素的一种生殖激素。然而,深入研究发现,FSH也与围绝经开始的雌激素尚在正常水平的快速骨丢失密切相关,并相继发现破骨细胞、骨髓间充质干细胞和脂肪细胞表达FSHR。因此认为,围绝经开始的及绝经和衰老(包括男性)所致的FSH水平升高,可能是导致骨质丢失和内脏脂肪积累的主要原因。研究者开发了针对FSH的多克隆和单克隆抗体,此抗体与FSH结合阻断其生物学作用,则抑制骨吸收和刺激骨形成而增加骨量,同时也降低体脂,其作用机制是垂体前叶分泌的FSH先与FSH抗体结合(图 1),阻断FSH与破骨细胞(osteoclasts, OC)、骨髓间充质干细胞(mesenchymal stem cells, MSC)和白色脂肪组织(white adipose tissue, WAT)中脂肪细胞的FSHR相互作用,从而抑制OC活性和刺激骨髓MSC向成骨细胞(osteoblast, OB)分化诱导骨量增加,同时抑制骨髓MSC向脂肪细胞分化,诱导WAT向米色/棕色脂肪组织(brown adipose tissue, BAT)转化,以及合成解偶联蛋白1(uncoupling protein 1, Ucp1)和细胞线粒体密度(mitochondrial density, MD)增加,导致脂肪组织产热增加而降低体脂。成骨细胞和脂肪细胞共同起源于骨髓MSC,但两者的分化存在相反的密切关系,骨髓脂肪细胞与成骨细胞分化平衡的研究显示,促进成骨细胞生成的信号因子则抑制脂肪细胞生成,反之亦然。FSH也是调节脂肪合成的重要因子,当其与骨髓MSC的FSHR结合,则驱使MSC朝向脂肪细胞谱系分化而增加内脏脂肪积累,同时减弱MSC向成骨细胞谱系分化而降低骨形成。FSH抗体阻断FSH与FSHR之间的相互作用,从而有利于MSC向成骨细胞分化,弱化了脂肪细胞的生成。
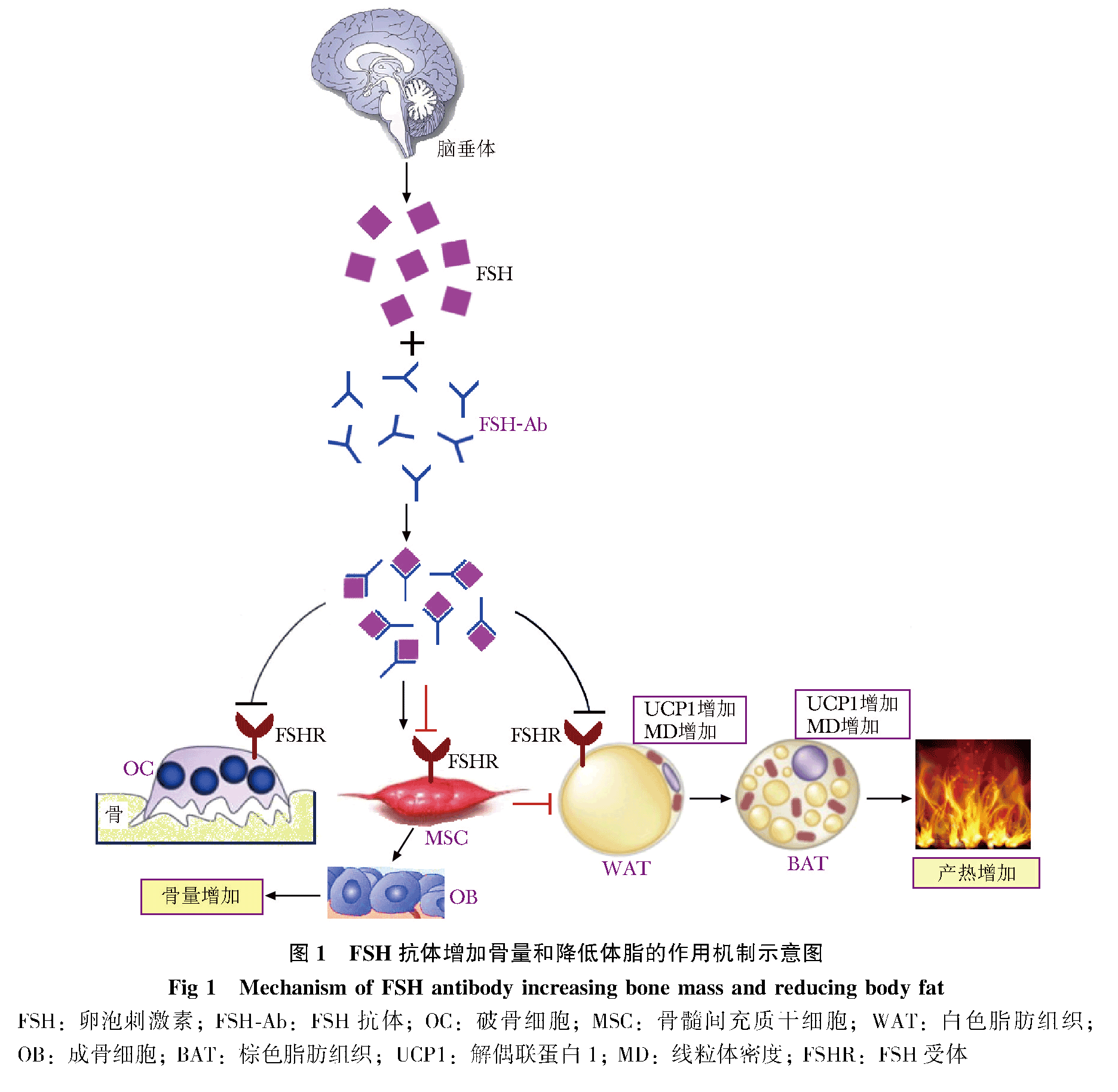
为了研究有效的FSH抗体,并阻断FSH与FSHR之间的生物学作用,研究者分析了FSH与FSHR胞外域复合物的晶体结构模型,发现FSHβ的环状结构被卷入FSHR的小凹槽中,掩埋在FSH β-FSHR结合界面处的FSHβ残基,经胰蛋白酶水解FSH的肽片段质谱法分析,发现与FSHR结合的小鼠FSHβ亚单位为LVYKDPARPNTQK组成的长度为13个氨基酸的保守肽序列,与人类FSHβ的LVYKDPARPKIQK肽序列只存在2个氨基酸的差异。FSH抗体的相对分子质量约为50 000,该抗体与FSHβ结合后将完全屏蔽FSHβ进入FSHR的结合口袋,从而阻止FSH与FSHR的相互作用。
FSH抗体增加骨量
基础研究显示,FSH刺激人单核细胞表达细胞核因子κB受体活化因子,促进破骨细胞分化和骨吸收,以及加速去卵巢大鼠的骨丢失。对人类的研究显示,循环中的FSH水平与骨转换指标呈显著正相关关系,与骨密度(bone mineral density, BMD)和骨丢失率呈显著负相关关系,FSH水平是骨转换指标、骨密度和骨丢失率变化的重要独立决定因素,与女性绝经后骨质疏松患病率和患病风险增加密切相关。针对FSHβ亚单位的单克隆抗体或多克隆抗体可以减弱破骨细胞生成和增加骨量。研究者对14周龄雌性小鼠去卵巢,注射FSH抗体(100 μg/d)连续干预4周,微-CT测量结果显示小鼠的骨体积/总体积(bone volume/total volume, BV/TV)、骨小梁数量(trabecular number, TbN)和连接密度(connectivity density, ConnD)均显著高于注射IgG的对照组,骨小梁间距(trabecular spacing, TbSp)则显著低于对照组。这种现象提示,FSH抗体阻断了FSH与其受体结构域的相互作用,降低了早期卵巢切除诱导的骨质丢失。研究还证实,FSH抗体也抑制骨吸收和刺激骨形成。经FSH抗体治疗后小鼠骨髓培养物中,形成抗酒石酸酸性磷酸酶阳性(tartrate-resistant acid phosphatase, TRAP+)破骨细胞的数量显著减少,骨吸收表面积显著低于注射IgG的对照组,与此相反,FSH则刺激TRAP+破骨细胞形成增加。骨组织形态计量学分析显示,无论是去卵巢或假性去卵巢,FSH抗体治疗小鼠的骨形成指标矿化表面积(mineralized surface, MS)、矿化沉积率(mineral apposition rates, MAR)和骨形成率(bone formation rates, BFR)均显著高于对照组。研究还发现,采用FSH抗体干预去卵巢小鼠4周后,从小鼠骨髓分离的间充质细胞培养后,碱性磷酸酶阳性的成纤维细胞集落形成单位(colony forming units-fibroblastic, CFU-f)和von Kossa染色阳性的成骨细胞集落形成单位(colony forming units-osteoblastic, CFU-ob)的数量均显著高于注射IgG的对照组。这种现象与FSHR基因敲除(FSHR-/-)小鼠骨髓间充质细胞的培养结果完全一致。最新研究显示,对高脂饮食喂养的3月龄雄性小鼠,采用FSH抗体(200 μg/d)分别连续治疗4周和7周,DXA测量结果显示小鼠全身总体BMD均显著高于注射IgG的对照组。
研究者认为FSH抗体与其他治疗骨质疏松的方法具有不同的效果,它能通过解偶联作用分别降低骨吸收和刺激骨形成。骨吸收与骨形成通常是紧密偶联的,几乎各种减少骨吸收的治疗药物也减少了骨形成,反之亦然。如注射骨形成药物甲状旁腺素(parathyroid hormone, PTH)时,虽然骨形成增加,但骨吸收也增加,从而损害其对骨的净合成作用。同样,双磷酸盐药物抑制骨吸收,但也减少骨形成。因此,基于选择性抑制FSH的药物,代表治疗骨质疏松的一种范例,它既可以减少骨吸收又可以增加骨形成而具有治疗优势。
FSH抗体降低体脂
在人类衰老过程中,随着绝经和年龄的进展,循环中的FSH水平急剧增加,无论女性或男性,体质量指数(body mass index, BMI)随FSH水平而增加,两者呈显著正相关关系(女性r=0.710,男性r=0.553),高水平FSH对脂肪组织的增加起重要作用。FSH促进3T3-L1脂肪细胞系和人前体脂肪细胞分化,其作用具有浓度依赖性。体外和体内实验均表明,FSH促进脂肪生成和脂肪储存。已在脂肪组织和各种脂肪细胞中鉴定到FSH受体cDNA及其蛋白质表达。人类脂肪细胞的FSHR与其他细胞类型的FSHR具有同源性,相对分子质量约78 000。女性与男性之间,以及女性不同绝经状态下(绝经前、围绝经期和绝经后),皮下脂肪和内脏脂肪细胞的FSHR表达水平差异均无统计学意义。FSH经Gαi蛋白的介导作用与脂肪细胞膜上的FSHR偶联,刺激Ca2+内流,环磷酸腺苷(cyclic adenosine monophosphate, cAMP)反应元件结合蛋白(cAMP-response- element-binding protein, CREB)被磷酸化,并激活一系列参与脂质生物合成的基因,促进脂肪合成增加,表明FSH及其受体介导人类衰老过程中脂肪组织的代谢障碍。最新研究发现,阻断FSHR信号传导途径,可以诱导产热脂肪组织生成和降低体脂。
众所周知,WAT与BAT(包括褐色/米色脂肪组织)的功能完全相反,WAT的主要功能是储存能量,BAT的功能则是通过细胞线粒体的Ucp1产生热量和消耗能量,防止体温过低和肥胖。从小鼠白色脂肪库中分离到的米色脂肪细胞与白色脂肪细胞类似,Ucp1的表达水平极低,但米色脂肪细胞与经典棕色脂肪细胞一样,应对cAMP刺激则表达高水平Ucp1。经鉴定米色脂肪细胞具有与棕色脂肪细胞或白色脂肪细胞不同的基因表达模式,并且优先对多肽激素鸢尾素(Irisin)敏感。从成人体内发现的棕色脂肪沉积物是由米色脂肪细胞组成的。白色脂肪转化为米色脂肪与脂肪细胞的线粒体密度增加有关。脂肪细胞的线粒体调节脂肪细胞分化、凋亡、氧自由基的产生和氧化磷酸化的效率,以及调节白色脂肪细胞转化为米色脂肪细胞,在肥胖的发展中起重要作用。BAT消耗能量的能力取决于线粒体Ucp1的表达水平,Ucp1是棕色和米色脂肪细胞产热的主要调控因子。缺乏Ucp1基因的家猪敲入Ucp1后,体内脂肪堆积量显著减少24%和瘦肉率显著增加3.4%。因此,棕色/米色脂肪组织和Ucp1与代谢性疾病(如肥胖和2型糖尿病)的发病机制密切相关。
最新研究显示,FSH抗体诱导白色脂肪细胞向米色脂肪细胞转化、脂肪细胞的线粒体生物合成增加和Ucp1表达量增加。研究者对C57BL/6J雌性和雄性小鼠采用高脂饮食喂养,3月龄时注射FSH抗体干预8周后,雌性小鼠腹股沟WAT(iWAT)的脂肪细胞平均面积和周长显著下降,iWAT和BAT切片免疫染色显示Ucp1标记显著增加。在FSH抗体干预1个月和3个月时,iWAT的Ucp1基因表达量分别显著增加200倍和4倍(与注射IgG的对照组比较),BAT中Ucp1基因的表达量也显著增加1.5倍。在雄性小鼠,同样显示FSH抗体刺激脂肪细胞线粒体生物合成和Ucp1表达,小鼠腹部和背部的热辐射强度显著增加,皮下WAT、内脏WAT和BAT的脂肪细胞体积变小和浓缩。这些现象提示,FSH抗体阻断FSH与FSHR的相互作用,诱导白色脂肪细胞向米色脂肪细胞转化,刺激脂肪细胞线粒体生物合成增加和激活Ucp1表达。但是,FSH抗体诱导产生的这种米色脂肪细胞,不能确定其是否来自前体脂肪细胞,或是从成熟的白色脂肪细胞转化而来,又或是两种机制的组合所致。Cinti认为Ucp1是脂肪器官可塑性的分子中心,这种可塑性不仅通过干细胞的增生和分化发生,而且还可以在适当条件下刺激成熟脂肪细胞的直接转化,改变它们的表型和功能。
最新研究还显示,FSH抗体降低高脂饮食和去卵巢引起的肥胖。研究者采用高脂饮食喂养C57BL/6J雌性和雄性小鼠,3月龄时每天于腹膜内注射FSH抗体,连续干预8周后小鼠体质量显著下降(与注射IgG对照组比较),定量核磁共振(quantitative nuclear magnetic resonance, qNMR)测量结果显示,无论是雌性或雄性小鼠,FSH抗体干预组的脂肪量(fat mass, FM)和脂肪量比体质量(FM/TM)、iWAT和性腺白色脂肪组织(gWAT)均显著下降,瘦组织量(lean mass, LM)比体质量(LM/TM)则显著增加;微-CT测量显示FSH抗体干预组的总体脂肪体积(total fat volume, TFV)、皮下脂肪体积(subcutaneous fat volume, SFV)和内脏脂肪体积(visceral fat volume, VFV)均成倍减少。FSH抗体干预FSHR转基因雄性小鼠同样显示,体质量、脂肪量、FM/TM、TFV、SFV和VFV均显著降低,提示在体内FSH抗体通过抑制FSH信号轴起作用,FSH是脂肪量的主要生理学调节剂。代谢笼间接能量测试结果显示,FSH抗体干预组小鼠24 h平均氧消耗量、能量消耗量、步行距离和步行速度均显著增加,与该抗体诱导BAT和WAT中的Ucp1表达结果相一致。FSH抗体干预对小鼠的葡萄糖和胰岛素耐量试验、血浆C-肽、脂联素、瘦素、总胆固醇、游离脂肪酸和雌激素水平无显著性影响。FSH抗体也同样降低去卵巢(OVX)和假性去卵巢(Sham)小鼠的肥胖症,采用正常饮食喂养雌性小鼠,3月龄时分别去卵巢和假性去卵巢,与注射IgG的对照组比较,FSH抗体干预的OVX组和Sham组小鼠的脂肪量、FM/TM、TFV、SFV和VFV均显著降低,但LM/TM显著增加。有趣的是FSH抗体也显著降低了Sham小鼠的脂肪量。同样,在自由获取正常饮食和限制饮食量的两组小鼠,FSH抗体分别干预5周和7周后,小鼠的脂肪量、FM/TM、TFV、SFV和VFV均显著低于注射IgG的对照组,LM/TM则显著高于对照组。研究者认为,这些重要发现是在多个实验室进行的,结果具有可重复性,无论是雌性或雄性小鼠,去卵巢或假性去卵巢,正常饮食或高脂饮食,自由进食或限制进食,FSH抗体干预后均能显著降低小鼠体内的脂肪组织。
综上所述,因绝经或/和衰老所致循环中的FSH水平上升,刺激破骨细胞骨吸收增加和骨髓间充质干细胞的成骨分化减少所致骨丢失增加和骨量下降,以及高水平FSH刺激骨髓间充质干细胞的成脂分化增加所致的肥胖,采用FSH抗体阻断FSH的生物学作用,不仅可以抑制骨吸收和刺激骨形成而防治骨质疏松,而且也可以有效降低内脏脂肪和皮下脂肪组织,对某些与内脏肥胖有关的疾病如代谢综合征、2型糖尿病、心血管病和多囊卵巢综合征,以及某些促炎性反应的细胞因子引起的并发症提供有益的治疗。因此,FSH抗体有望成为同时预防骨质疏松和肥胖的潜在药物,为降低骨质疏松及其骨折、2型糖尿病、代谢综合征和心血管病的患病风险提供新的途径。