蛇床子素对NFATc1基因表达及破骨细胞分化的影响
来源:CSOBMR 发布日期:2019-02-12 09:53:44浏览:10508次
作者:王礼宁1 马勇1,2 郑苏阳1 郭杨1 潘娅岚1 王磊1 顾鸣1 孙杰1
单位:
1、南京中医药大学骨伤研究所骨伤修复与重建新技术实验室
2、南京中医药大学附属医院骨伤科
摘要:目的 研究蛇床子素(osthole, OST)对破骨细胞形成和骨吸收的影响,并初步分析其分子机制。方法 体外构建破骨细胞诱导培养体系,通过抗酒石酸酸性磷酸酶染色(tartrate resistant acid phosphatase, TRAP)法、骨吸收陷窝扫描电镜观察鉴定成熟破骨细胞,采用CCK-8(cell counting kit-8)法筛选无细胞毒性的药物浓度组,使用细胞骨架荧光染色法观察OST对其形态的影响。使用骨吸收陷窝甲苯胺蓝染色进行面积定量分析,并统计吖啶橙荧光染色后凋亡破骨细胞的比例,采用荧光定量PCR法测定OST对NFATc1等相关破骨基因表达的影响。结果 体外成功构建破骨细胞培养体系,通过CCK-8法筛选出10-6、10-5 mol/L两组药物浓度。OST可使破骨细胞肌动蛋白环变细,伪足和褶皱区消失。OST 0、10-6、10-5 mol/L组TRAP染色阳性数目分别为104.6±4.5、80.4±3.7、58.2±3.1,融合指数分别为(44.3±3.3)%、(20.3±0.9)%、(12.6±0.6)%,各浓度组组间比较,差异均有统计学意义(P<0.05);该3组诱导的破骨细胞产生的骨陷窝数目为41.67±1.16、34.01±2.65、26.33±4.16,骨陷窝面积(μm2/片)分别为1 445 942.0±164 150.0、904 080.8±47 346.0、641 049.1±1 993.0,各浓度组组间比较,差异均有统计学意义(P<0.05);该三组破骨细胞凋亡率分别为:26.3%、30.1%、37.2%,OST组凋亡率较对照组明显升高,且差异有统计学意义(P<0.05),但两浓度组之间差异无统计学意义(P>0.05)。RANKL诱导后NFATc1、CTSK、MMP-9、TRAP、INTE-BETA3、C-SRC的mRNA表达量分别为空白组的2.147±0.246、30.5±1.643、43.54±2.908、9.116±0.392、6.664±0.395、4.131±0.408倍,与空白组相比表达量均明显升高,差异具有统计学意义(P<0.01);OST干预后,各组表达量均受到明显抑制,OST组表达量与RANKL对照组相比差异也均具有统计学意义(P<0.05)。除了NFATc1外,两浓度组组间比较,差异均有统计学意义(P<0.05)。结论 OST可以通过调控NFATc1等破骨基因表达抑制破骨细胞的分化。
关键词:蛇床子素;破骨细胞;NFATc1;骨质疏松
蛇床子素(osthole,OST),是中药蛇床子中一种主要的活性成分。现代药理学研究发现其具有抗炎解痉、抗心律失常、抗肿瘤、抗过敏和增强免疫功能等作用。近年,人们发现其在防治骨质疏松症上也具有一定的作用。鲍君杰等发现蛇床子素能明显改善去卵巢大鼠骨质疏松模型中的股骨骨密度和降钙素(calcitonin, CT)、骨钙素(bone glaprotein, BGP)、雌二醇(estradiol, E2)等血清生物化学指标。明磊国等发现10-5 mol/L的OST可提高成骨细胞中相关成骨基因的表达,促进钙盐沉积和骨钙素的分泌,从而增强成骨活动。
骨稳态作为一个复杂的生理过程,主要由成骨细胞介导的骨形成和破骨细胞介导的骨吸收所构成。OST抗骨质疏松的研究目前多集中在动物体内实验和对体外培养成骨细胞的作用,而其对破骨细胞的关注不多。本研究欲考察OST对体外培养破骨细胞的影响,以进一步验证蛇床子素在调节骨代谢,促进骨稳态方面的药理学作用。
材料与方法
实验动物
出生24 h内的SD大鼠雌雄各3只,来源于南京江宁青龙山动物繁殖场,实验动物合格证书:SCXK(苏)2012-0008。实验过程中对动物的处置符合2009年《Ethical issues in animal experimentation》相关动物伦理学标准的条例。
试剂与仪器
试剂:胎牛血清、α-MEM培养基(美国Gibco公司);巨噬细胞集落刺激因子(macrophage colony stimulating factor, M-CSF)、核因子κB受体活化因子配基(receptor activator for nuclear factor kB ligand, RANKL)(美国Peprotech公司);CCK-8试剂盒(日本同仁化学研究所);TRAP染色试剂盒、甲苯胺蓝、吖啶橙荧光染料(美国Sigma公司);FITC-Phalloidin染液、DAPI染液(美国Invitrogen公司);RNAiso Reagent、反转录试剂盒、SYBR GREEN qPCR试剂盒(日本Takara公司);所有引物由上海生工公司设计合成。
仪器:倒置相差显微镜CKX31型(日本Olympus光学仪器株式会社);倒置荧光显微镜DMI-3000型(德国徕卡公司);全自动硬组织切片机RM2265型(德国徕卡公司);CO2培养箱BB16/BB5060型(德国Heraus公司);环境扫描电镜Quanta 200型(美国FEI公司);多功能酶标仪(美国PE公司);实时荧光定量PCR仪7500型(美国ABI公司)。
实验方法
大鼠破骨细胞体外培养体系的建立:按照本课题组稳定使用的分离诱导方法,无菌条件下从大鼠的胫骨和股骨中分离出骨髓单核细胞,裂解红细胞、纯化后,用含25 μg/L的M-CSF、100 μg/L的RANKL的培养基诱导培养,在培养第5~6天即可在倒置显微镜下观察到成熟的破骨细胞。
细胞活性检测:将骨髓单核细胞按照每孔104个接种于96孔板中,过夜贴壁后更换终浓度为10-4、10-5、10-6 mol/L、0(含0.25% DMSO的溶剂对照组)的含药培养基,加上不含细胞的空白组共为5组,每组设3个复孔。所有组的培养基中均含有20 μg/L的M-CSF以维持细胞的正常生长,隔天换液。分别在用药干预的第8、24、48 h、5、7 d时采用CCK-8法检测细胞活性。每孔加入10 μL CCK-8检测液,放入培养箱中37 ℃孵育4 h,用酶标仪检测其在450 nm处的吸光度,采用公式计算出细胞活性。
细胞骨架肌动蛋白环(FITC-phalloidin)荧光染色:将生长状态良好的骨髓单核细胞轻轻吹下,按照每孔2×104个细胞的接种于12孔板中,分为2组,每组3个复孔。对照组中加入含25 μg/L的M-CSF、100 μg/L的RANKL的培养基诱导培养,实验组诱导培养方式同对照组,但在染色前用含10-5 mol/L OST的培养液作用5 h。
染色方法:移除培养基,用预冷的4%多聚甲醛固定5 min,PBS洗3次,0.1% Triton X-100(PBS稀释)室温孵育15 min,加入FITC-Phalloidin工作液(5 mg/L,1% BSA稀释)避光孵育1 h,PBS洗3次后,DAPI染液复染3 min,PBS清洗后,尽快在荧光显微镜下观察。
TRAP染色:将生长状态良好的骨髓单核细胞按照1.5×105/cm2的密度接种于48孔板中,分为DMSO阴性组、RANKL对照组、OST 10-6 mol/L组、OST 10-5 mol/L组共4组,每组3个复孔,除阴性组外都添加含25 μg/L的M-CSF、100 μg/L的RANKL的培养基,隔天半量换液,诱导5 d后,按照TRAP染色试剂盒说明进行染色。倒置显微镜下观察,计算TRAP阳性多核细胞数(100倍下随机选取5个视野,计数细胞核≥3,重复3次)和融合指数(TRAP阳性多核细胞数占该孔所有TRAP阳性细胞的百分比)。
甲苯胺蓝染色和扫描电镜观察:取新鲜牛股骨皮质沿纵轴切取2 cm厚的骨片,并用硬组织切片机、磨片机制成厚约80 μm,面积为0.5 cm×0.5 cm的薄骨片。使用前,超声清洗3遍,每遍1 h。再放入75%乙醇中浸泡1 h,并放入超净台中正反两面紫外各照射一次,最后放入培养基中备用。诱导5 d后,2.5%的戊二醛固定5 min,氨水超声清洗3 min,自然晾干,1%的甲苯胺蓝染色3 min,蒸馏水清洗后显微镜下观察分析(100倍下随机选取5个视野采用Image Pro Plus 6.0图像分析软件进行骨吸收陷窝的面积分析)。电镜样品制备将戊二醛固定、超声清洗后的骨片放入梯度乙醇中进行脱水处理(50%、70%、80%、90%、95%各15 min),再用醋酸异戊酯置换乙醇,CO2临界点干燥,真空离子镀膜,在扫描电镜下观察骨陷窝的超微结构。
吖啶橙荧光染色:诱导5 d后,4%多聚甲醛固定10 min,1%的醋酸酸化1 min,PBS清洗3 min,加入0.01%吖啶橙染液染色5 min,PBS清洗3次,每次3 min后,尽快在荧光显微镜下观察细胞的凋亡情况,计算每组的凋亡破骨细胞数目与破骨细胞总数的百分比(凋亡率)。
荧光定量PCR:将生长状态良好的骨髓单核细胞按照1.5×105/cm2的密度接种于12孔板中,实验组加入OST预处理细胞3 h,然后除了阴性组以外更换含25 μg/L的M-CSF、100 μg/L的RANKL的含药培养基,作用24 h后采用Trizol法提取细胞总RNA,紫外分光光度计检测RNA浓度及纯度,反转录体系、PCR扩增体系均按照说明书设定,反应完成后进行扩展曲线和溶解曲线的分析。目的基因引物序列见表 1,以GAPDH为内参校正,采用2-△△CT法求得目的基因的相对表达水平。

统计学方法
采用SPSS19.0软件进行统计分析,计量资料用均数±标准差(x±s)表示,对TRAP阳性细胞数、骨吸收数目和面积等进行单因素方差分析,组间比较用Student-Newman-Keuls(SNK)检验,对凋亡率、融合指数进行χ2检验,组间比较采用Scheffe可信区间法,P<0.05为差异有统计学意义。
结果
OST对细胞活性的检测结果
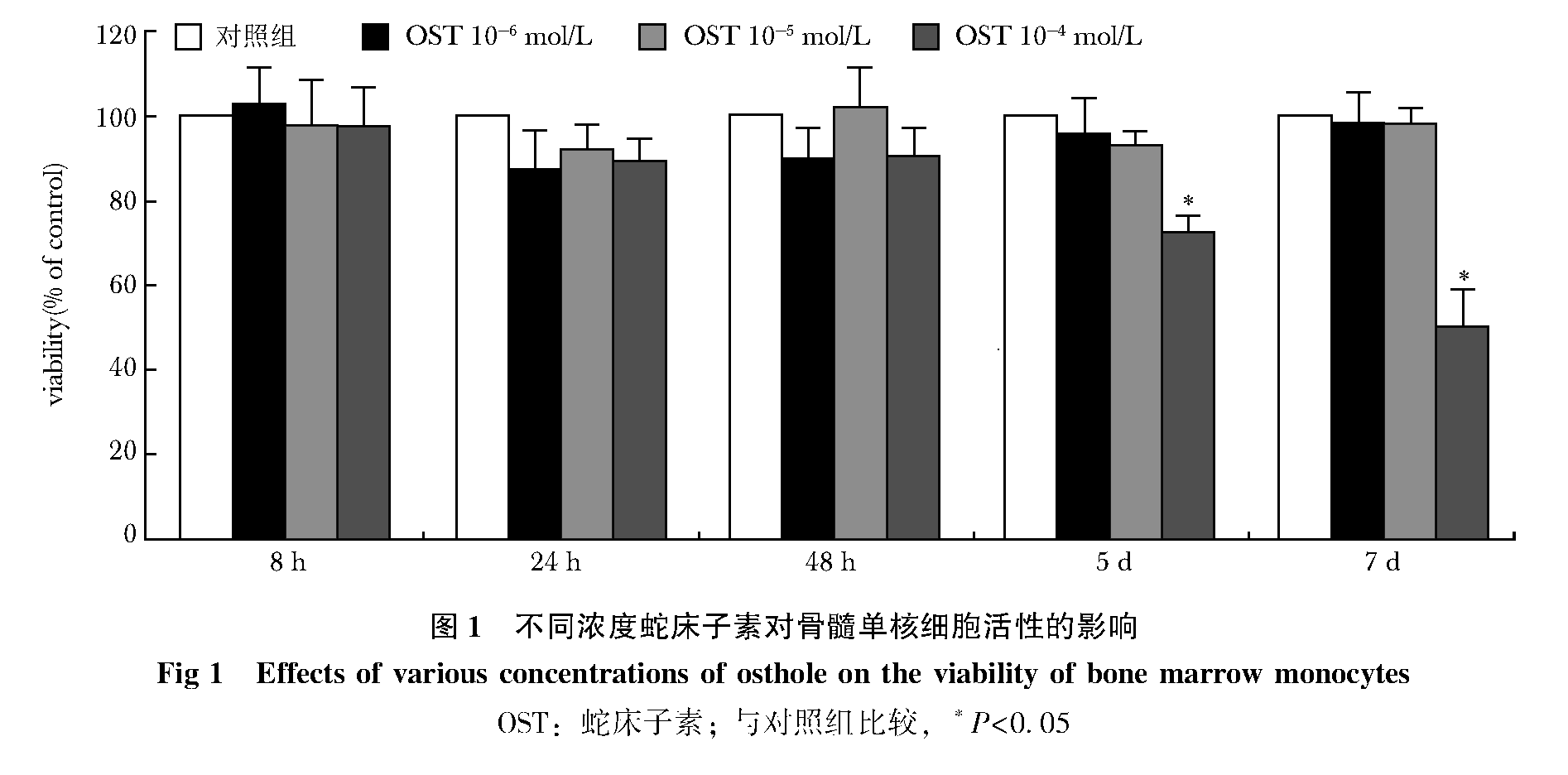
CCK-8检测结果显示,对照组、10-6 mol/L组、10-5 mol/L组在设置的各个时间点上检测的细胞活性结果均无明显变化,组间比较差异无统计学意义(P>0.05)。10-4 mol/L组在5和7 d两个时间点,细胞活性受到明显抑制,其中7 d下降更为明显,两时间点相比于组内对照组,差异均有统计学意义(P<0.05)(图 1)。
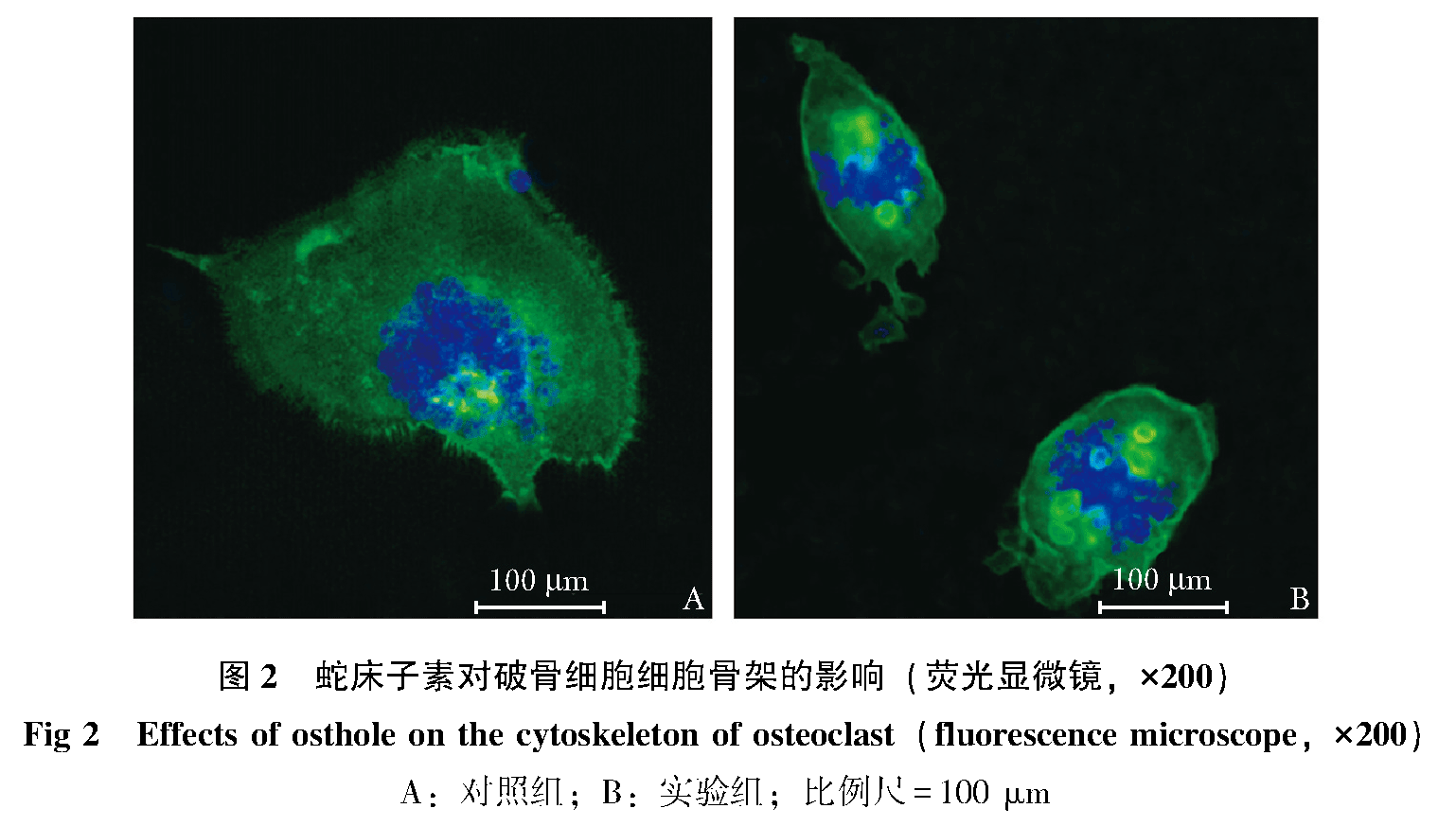
OST对破骨细胞肌动蛋白环的影响
正常成熟破骨细胞的肌动蛋白环上有较明显的伪足和褶皱区(图 2A),这些结构是破骨细胞能够附着在骨组织表面发挥骨吸收功能的重要区域;但细胞在10-5 mol/L OST作用5 h后,可发现大多数破骨细胞的伪足和褶皱区消失,肌动蛋白环变细甚至消失,细胞体积缩小,形态结构发生了一定的改变(图 2B)。
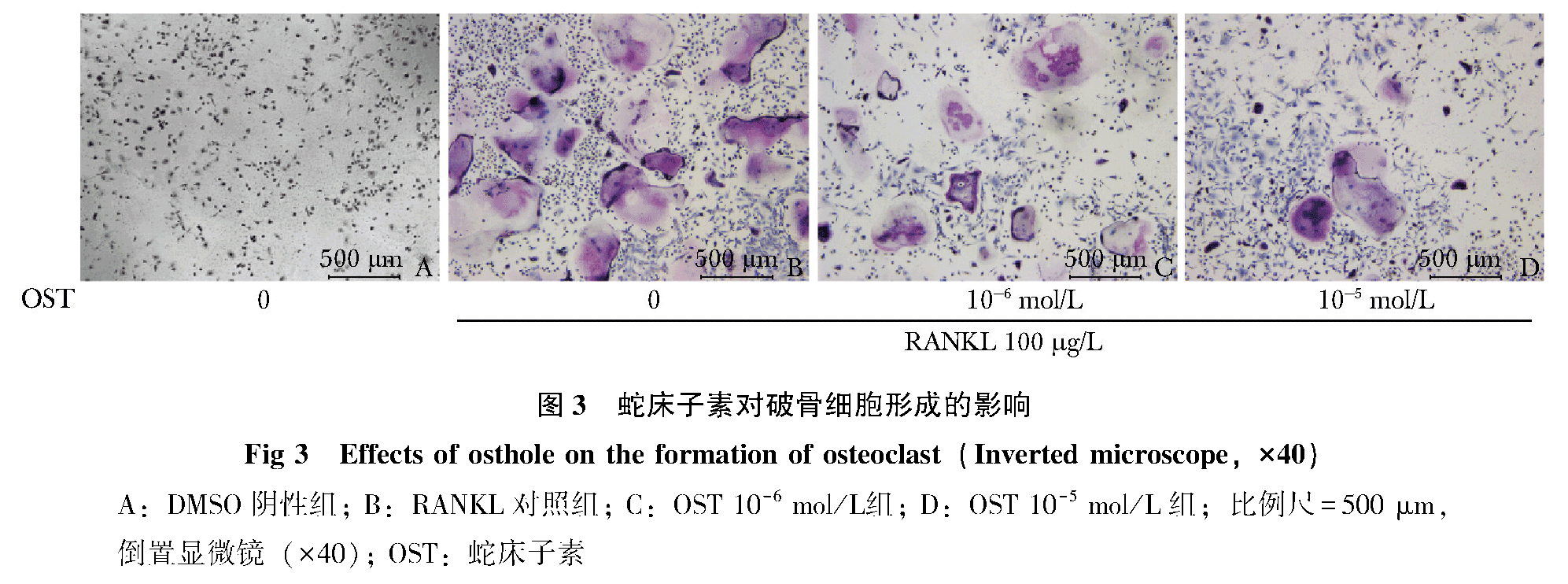
OST对破骨细胞形成的影响
骨髓单核细胞用M-CSF、RANKL诱导5 d后,即可在镜下出现典型的TRAP阳性细胞:细胞体积较大(50~200 μm);形态多为椭圆形或者不规则形,细胞质中可出现大量紫红色的颗粒,分布均匀,伪足和褶皱清晰可见;复染苏木精后细胞核较为清晰,呈淡紫蓝色。TRAP阳性细胞计数结果为:DMSO阴性组、RANKL对照组、OST 10-6 mol/L组、OST 10-5 mol/L组分别为0、104.6±4.5、80.4±3.7、58.2±3.1,OST给药组的TRAP阳性细胞数明显减少,且浓度越高,抑制效果更明显(图 3),给药组与RANKL对照组比较差异有统计学意义(P<0.05)。融合指数4组结果为:0、(44.3±3.3)%、(20.3±0.9)%、(12.6±0.6)%,给药后的融合指数也受到抑制,且OST 10-5 mol/L组抑制效果更明显,给药组与RANKL对照组比较差异有统计学意义(P<0.05)。
OST对破骨细胞骨吸收功能的影响
骨髓单核细胞在含有骨片的培养基中诱导培养5 d后,可在骨片上发现较明显的骨吸收陷窝,扫描电镜下可清晰的看到骨陷窝的轮廓和形态(图 4C)。甲苯胺蓝染色后骨片上的陷窝呈现较明显的紫绿色(图 4B)。经统计加药组骨陷窝数目、骨陷窝面积、骨陷窝平均面积3项参数均低于RANKL诱导组,差异均具有统计学意义(P<0.05),且高浓度组抑制效果更为明显,高浓度组在骨陷窝数目和骨陷窝面积两项参数上与RANKL诱导组相比具有统计学意义(P<0.05)(表 2)。
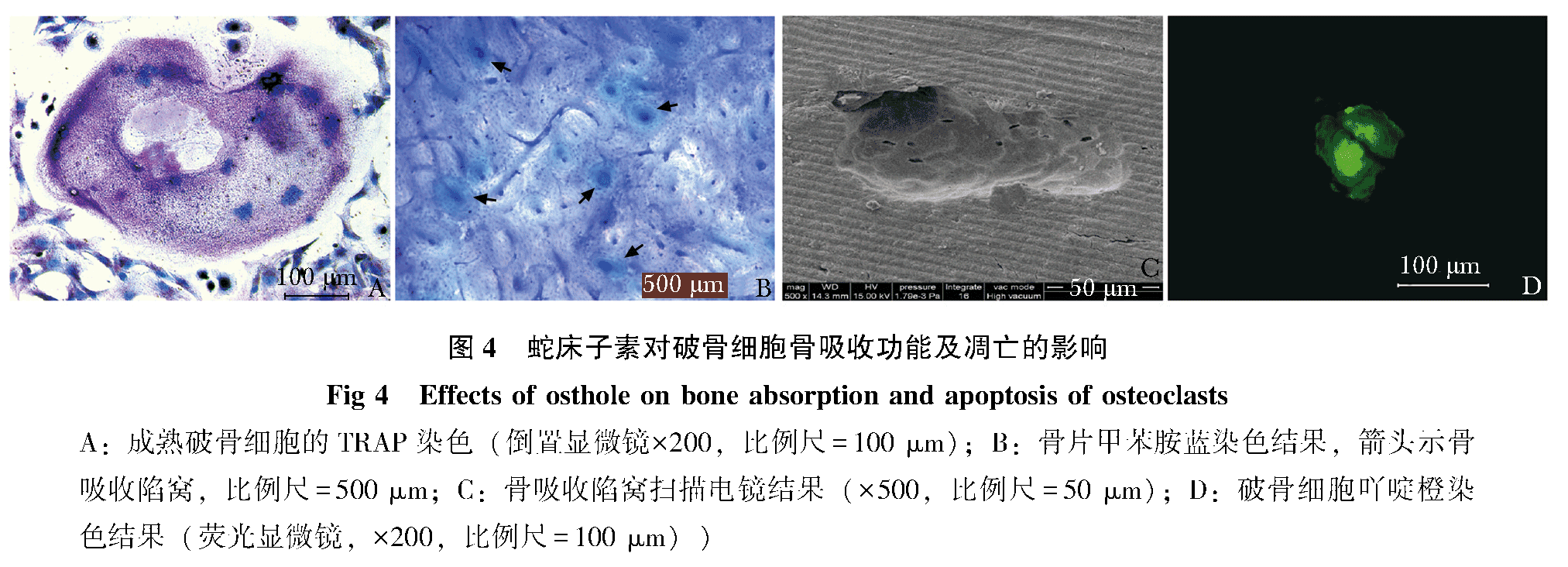
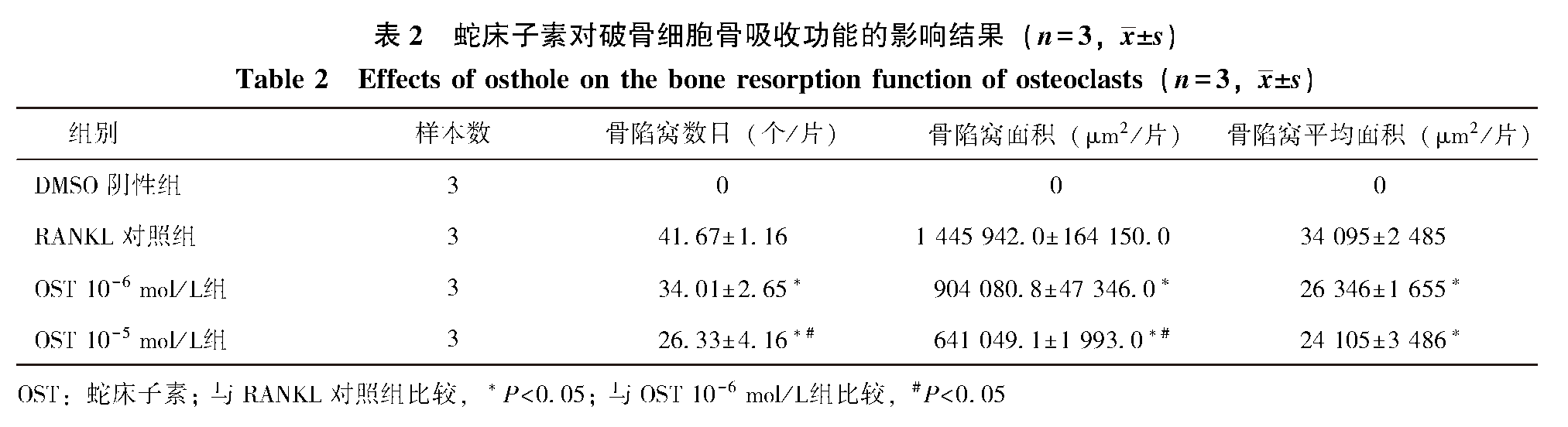
蛇床子素对破骨细胞凋亡的影响
凋亡细胞的染色质会固缩或断裂为大小不等的片段,形成凋亡小体。吖啶橙染色后荧光显微镜下可观察到细胞会染上致密浓染的绿色荧光或绿色碎片颗粒(图 4D)。OST用药组相较于对照组能明显促进破骨细胞的凋亡(P<0.01)。其中10-5 mol/L组的抑制效果更明显,凋亡率比对照组提高了11%(表 3)。

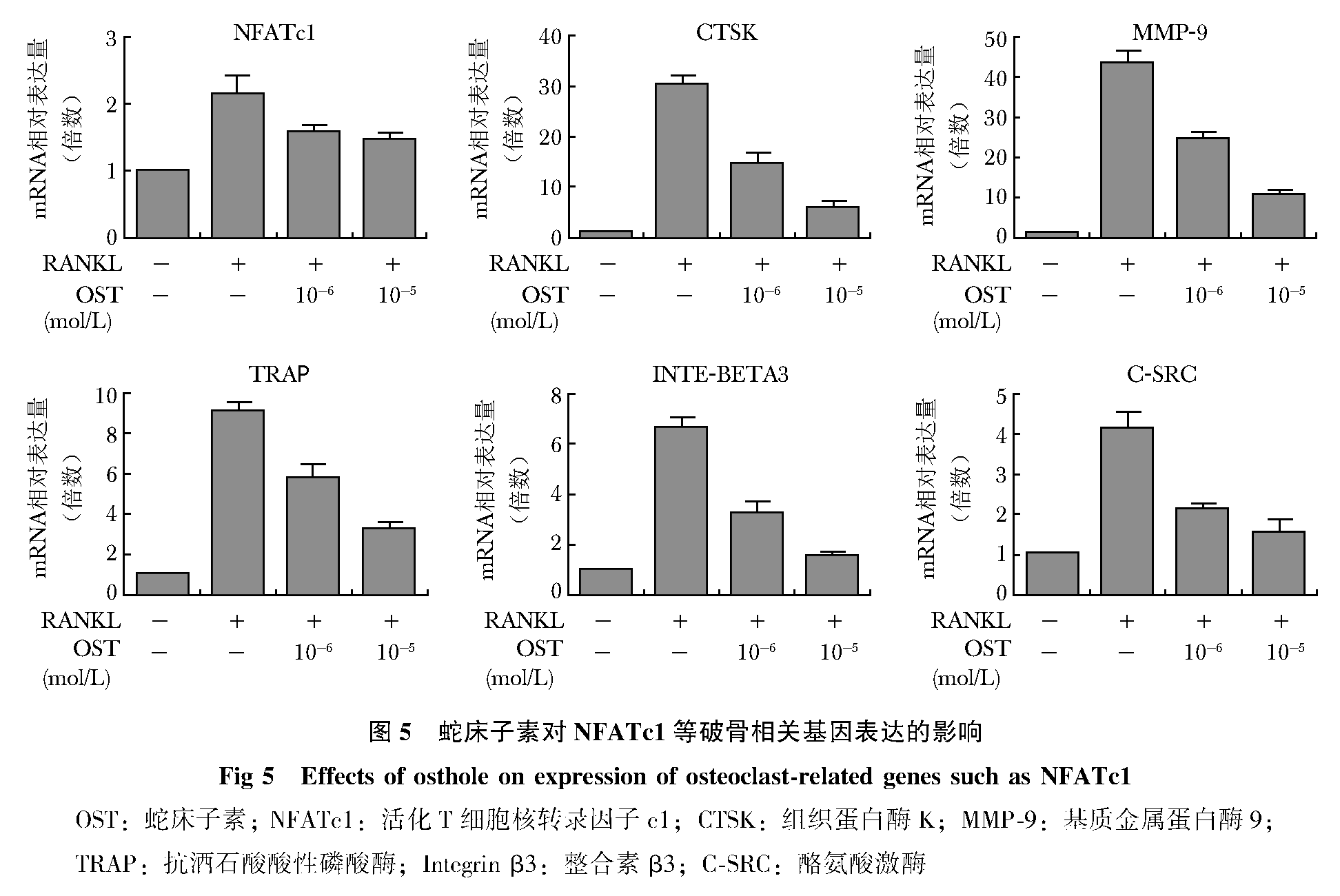
OST对NFATc1等破骨相关基因表达的影响
各目的基因的溶解曲线均只见一个特异性峰,引物的特异性结合良好。且扩增曲线均呈“S”型,底物的扩增效率较高。RANKL诱导细胞24 h后NFATc1、CTSK、MMP-9、TRAP、INTE-BETA3、C-SRC的mRNA表达量分别为空白组的2.147±0.246、30.5±1.643、43.54±2.908、9.116±0.392、6.664±0.395、4.131±0.408倍,与空白组相比表达量均明显升高,差异具有统计学意义(P<0.01)。加入OST干预后,各组的表达量均受到明显抑制,用药组的表达量与RANKL对照组相比差异也都具有统计学意义(P<0.05)。除了NFATc1外,两浓度组组间比较,差异有统计学意义(P<0.05)(图 5)。
讨论
破骨细胞(osteoclast),作为一种来源于造血细胞系的多核细胞,在保证骨的正常生长发育和维持骨稳态上发挥了重要作用。长期以来,因为破骨细胞是一种高代谢终末分化细胞,具有存活时间短、无法传代等特点,且破骨细胞在体内数量极少,机械分离获取较为困难。破骨细胞的相关研究一直是骨科基础学研究领域的一个难点。但是随着这些年来M-CSF和RANKL这两种细胞因子的发现,破骨细胞的诱导培养技术逐渐成熟,目前通过使用原代骨髓单核细胞诱导获得成熟破骨细胞的方法已获得大多数研究者的青睐,且使用原代细胞诱导基因差异较细胞系更小,获得的结果更具说服力。据此,本研究选择此诱导方法展开研究。
OST作为蛇床子中含量最高的一类羟基香豆素类化合物,含量约为1%左右。Kuo等发现OST可诱导成骨细胞分化,增加成骨细胞碱性磷酸酶的活性,其作用与促进BMP-2分泌和活化Smad1/5/8、p38以及ERK1/2激酶有关。Tang等证实了OST可激活β-catenin-BMP-2信号通路刺激成骨细胞分化和新骨生成,防止骨丢失,从基因水平验证了OST抗骨质疏松的作用机制。马勇等将OST和壳聚糖衍生物(NSC, N-succinyl-chitosan)合成了蛇床子素骨靶向药物,鉴于其良好的亲骨性和亲水性,一定程度上可以解决OST难溶于水的问题,并发现该靶向药物可以促进成骨细胞的增生,上调OPG/RANKL的比值,从而增强骨形成作用。然而有关OST对破骨细胞影响的研究较少,因此本研究选择从这方面验证OST抗骨质疏松的药理作用。
检索近几年来通过体外实验研究OST的相关文献,确定10-4 mol/L、10-5 mol/L、10-6 mol/L这3个常用的浓度梯度组,并通过CCK-8检测细胞活性的方法排除对骨髓单核细胞有一定毒性的10-4 mol/L组。在没有细胞毒性的状况下,本研究观察到了OST可以明显地抑制TRAP阳性破骨细胞的形成以及骨吸收活性的发挥,并在一定程度上促进破骨细胞的凋亡。因此,找寻OST抑制破骨细胞分化和骨吸收功能的潜在分子机制成为必然。
活化T细胞核转录因子c1(NFATc1)已被证明是破骨细胞形成和分化途径上不可缺少的调节因子。Takayanagi等发现了特异性敲除NFATc1基因的胚胎干细胞在RANKL的刺激下无法成功分化为破骨细胞。除此之外,NFATc1在破骨细胞的活化、融合和骨吸收功能的发挥中也扮演了重要的角色。NFATc1可直接通过结合启动子区域,从而调节靶基因的表达水平,最终起到调节破骨细胞的形成与功能发挥的作用。这些靶基因包括:影响破骨细胞的迁移和黏附的Integrin β3和C-SRC、影响破骨细胞降解酶的分泌和骨吸收活性的CTSK和MMP-9以及作为破骨细胞特异性标志酶的TRAP等。本研究中,OST能明显地抑制这些破骨相关基因的表达。因此,OST抑制破骨细胞的分化很有可能是通过下调这些相关基因的表达,并最终降低NFATc1的表达水平而起作用的。然而,OST对这些破骨相关基因的抑制效果要强于对NFATc1的效果,这一现象的原因还有待进一步的研究。
回顾前期的实验结果,笔者认为蛇床子素对骨代谢很可能具有双重调节作用。一方面OST能够通过内质网应激等通路促进成骨细胞的分化;另一方面,OST可以调控NFATc1等基因的表达抑制破骨细胞的形成和功能。综上,都进一步证明了蛇床子素作为中药蛇床子的单体成份具备了一定的抗骨质疏松的药理作用。实验过程中因为诱导获得的原代细胞数量问题,仅检测了基因转录水平的表达,缺少相关信号通路的上的蛋白检测,尚需在改进相关技术后进一步验证。