肌少症发病机制
来源:CSOBMR 发布日期:2019-01-17 10:43:52浏览:11294次
作者:杨明 游利
单位:上海交通大学附属第一人民医院内分泌代谢科(骨质疏松专科)
摘要:肌少症是与增龄相关的进行性、以全身肌量减少和(或)肌强度下降或肌肉生理功能减退为特征的综合征,其可使老年人的生活质量受到严重影响。肌少症是环境与遗传因素共同作用的复杂疾病,它的发生涉及多种风险因素和机制。充分了解肌少症的发病机制,有助于对其进行积极预防和治疗。
关键词:肌少症;发病机制;老年人
肌少症(sarcopenia)是一组与增龄相关的进行性、以全身肌量减少和(或)肌强度下降或肌肉生理功能减退为特征的综合征。老年人是肌少症和骨质疏松症的高发人群,同时这两种疾病又相互影响。故有学者提出将这两种疾病统称为“活动障碍综合征”(dysmobility syndrome)。肌少症可使骨质疏松的风险明显增加,容易引起跌倒以及骨折,同时骨质疏松症又使得肌少症患病率增加,这两种疾病常常同时出现,相互影响,使得老年人的病残率和病死率上升。但在国内外,肌少症的基础研究均属起步阶段,本文就肌少症发病机制的相关研究予以综述。
概述
肌少症源自于希腊语的sarx(肌肉)和penia(流失),最早由美国塔夫茨大学教授Irwin Rosenberg在1989年首次提出,1998年Delmonico等首先使用双能X线吸收仪(Dual energy X-ray absorptiometry,DXA)测量肌肉质量,提出肌肉质量低于年轻人群2个标准差者为肌少症。由于肌少症缺少共识以及诊断标准,使得学者对肌少症的研究遇到了严重的阻碍。为此,世界各地区都组建了自己的肌少症工作组并且制定了自己的诊断共识,其中包括欧洲老年肌少症工作组(EWGSOP)、国际肌少症工作组(IWGS)、亚洲肌少症工作组(AWGS)。目前广泛应用的肌少症概念是由EWGSOP在2010年提出的,它规定诊断应包括肌肉功能(physical performance)、肌强度(肌力,muscle strength)和肌量(muscle mass)3个要素。由于人种的的差异以及肌少症诊断方法的差异,各国肌少症的发病率在10%~25%,但在80~89岁的老年人中发病率可以高达50%。
肌少症发病机制
肌少症是一组与年龄相关的疾病,也是环境与遗传因素共同作用的复杂疾病,它的发生涉及多种风险因素和机制。
运动和营养相关因素
老年人如果缺乏运动,骨骼肌量更容易减少、肌力更容易下降,更容易患肌少症。虽然肌少症的发病率随年龄的增长而增加,但是运动却可以延缓甚至逆转这一过程。高强度抗阻训练可以增加股四头肌肌力,增加老年人的肌力,从而预防老年人跌倒以及骨折。研究表明,运动或者抗阻训练可以促使肌细胞分泌胰岛素样生长因子(insulin-like growth factor,IGF)以及一些IGF结合蛋白,这些细胞因子可以抑制肌肉萎缩并促使肌细胞再生;同时运动可以使肌肉分泌前列腺素而促进肌卫星细胞的增殖;运动还可以促使人体产生核心蛋白(Decorin),其可以和肌肉生长抑制因子(myostatin)结合抑制后者的功能从而促进成肌细胞的增殖和分化。肌肉重量约20%为蛋白质,老年人由于蛋白质合成降低或是由于其他原因导致的蛋白质消耗增多都会使肌少症发病率增加。运动训练联合补充氨基酸可以提高肌肉力量,改善肌肉功能。支链氨基酸可以增强哺乳动物雷帕霉素靶蛋白C1(mammalian target of rapamycin C1,mTORC1)的活性,降低活性氧对机体的破坏作用,同时其还具有通过泛素蛋白酶体途径(ubiquitin-proteasome system,UPS)抵抗恶病质的作用。
近年关于维生素D(vitamin D,VitD)的研究显示,除调节钙磷代谢的作用外,VitD还具有其他多种作用,包括可能在肌肉健康中起到重要作用。有研究表明,VitD与肌肉疼痛、跌倒有关,补充VitD对肌少症临床结局有改善作用。VitD通过维生素D受体(vitamin D receptor,VDR)起作用,VDR可以与类视黄醇X受体(retinoid X receptor,RXR)形成二聚体,结合到靶基因启动子的维生素D反应元件(vitamin D response element,VDRE)区域,发挥基因转录调节作用,进一步发挥调节矿物质代谢平衡、改善骨骼健康以及其他作用。VDR几乎在所有的细胞种类中都存在,但含量很低,在组织中鉴定VDR的存在是确定VitD功能的关键,但VDR的检测很困难。在骨骼肌中对VDR的研究结果并不统一,一些研究表明骨骼肌中存在VDR受体,而另一些研究则质疑这些结果,最近一项研究用PCR/Western和免疫组化等方法证明了骨骼肌中VDR的存在,但含量很低,且随年龄增加减少。而体外研究则表明,VDR及其靶基因产物CYP24A1在活性1,25羟基维生素D(1, 25-dihydroxyvitamin D)处理肌肉细胞时都表达升高,但这一结果仍然由于一些技术原因,如蛋白提取、肌肉模型和抗体特异性等受到怀疑,而新近的一项研究不仅在人肌肉细胞中检测了VDR,而且研究了VitD与VDR表达的关系。
相关激素
一些激素分泌的改变(例如胰岛素、生长激素、雌激素和雄激素等)有可能引起骨骼肌肌量的下降,最终导致肌少症。肌少症的发生可能与胰岛素抵抗有关,骨骼肌是人体最大的胰岛素靶器官,并且已经有实验证实老化的肌细胞受到胰岛素的作用以后,其蛋白质的生成能力会明显的降低。生长激素发挥作用是通过胰岛素样生长因子1(insulin-like growth factor,IGF-1)来介导的,IGF-1与受体结合通过磷脂酰肌醇三激酶(phosphatidylinositide 3 kinases,PI3K)促使磷脂酰肌醇二磷酸[phosphatidylinositol(4, 5)bisphosphate,PIP2]向磷脂酰肌醇三磷酸[phosphatidylinositol (3, 4, 5)-trisphosphate,PIP3]转化,正向调节丝氨酸/苏氨酸蛋白激酶B途径,进而增强下游的哺乳动物雷帕霉素靶蛋白(Mammalian Target of Rapamycin,mTOR)活性,促进蛋白质合成并且抑制Forkhead box O(FOXO)去磷酸化进而影响蛋白质的分解(图 1),但Das等通过基因敲除等一系列实验认为,PIP3激活丝氨酸/苏氨酸蛋白激酶B途径后,还可以活化腺苷三磷酸—枸橡酸裂解酶(adenosine triphosphate-citrate lyase,ACL)进而使腺苷三磷酸(adeno-sine triphosphate,ATP)生成增加,这对于提升线粒体的功能具有积极的作用,肌肉萎缩以及肌少症时,ACL的活性减低。
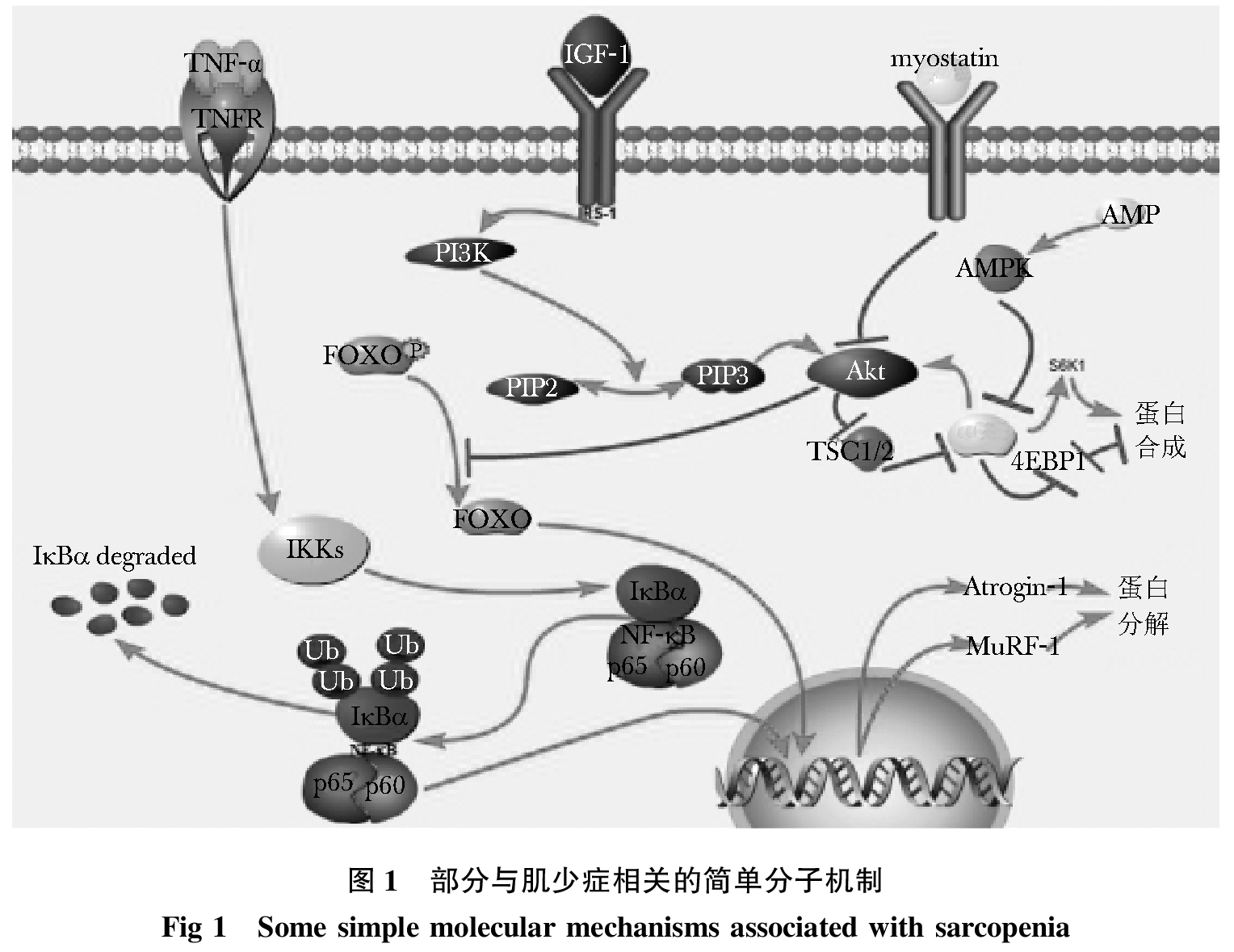
雌激素在肌少症的发病中所起的作用尚存在争议。有研究显示,经过雌激素替代治疗的患者股四头肌横断面面积更高,但与伸直肌强度无关。也有研究表明,替勃龙可增加股四头肌和伸膝直肌强度,且增加瘦组织量、降低体脂量。男性30岁后年龄每增加1岁,睾酮水平便会下降1%,睾酮水平下降会使骨骼肌蛋白合成减少,最终可能导致肌少症。睾酮疗法可以使得肌肉尺寸增大和改善肌力,同时还可以增加瘦组织的量,提升下肢力量和生理功能。但雄激素替代治疗不良作用较多,其临床效果需要进一步研究。
炎症及细胞因子
炎症因子增多亦是肌少症发生发展的重要因素之一。随着年龄增大,炎性因子肿瘤坏死因子α(tumor necrosis factor,TNF-α)、白细胞介素-6(interleu-kin-6,IL-6)、C反应蛋白(C-reactive protein,CRP)表达增加,活性氧生成增加,通过胞质钙依赖的钙蛋白酶或者丝裂原活化蛋白激酶系统或者NF-κB信号通路,使得蛋白质的分解增加,合成减少,最终导致骨骼肌质量减少。在TNF-α作用下,IκB激酶(inhibitor of nuclear factor kappa-B kinase,IKK)磷酸化IκB(inhibitor of NF-κB),解除IκB对NF-κB的隔离作用,使得NF-κB进入细胞核,从而通过NF-κB信号通路增加蛋白质的分解(图 1)。同时,脂肪组织中的脂肪细胞和浸润的巨噬细胞可以产生包括IL-6等多种炎性因子,加剧炎性反应。有研究表明,老化影响了锌的代谢,尤其是在肌肉中NF-κB和STAT3通路的激活有可能参与这一过程,锌转运蛋白-14(zinc transporter-14,Zip14)的消融会使得促炎性因子IL-6的水平升高,同时Zip14在骨骼中的正常功能在老化期间维持小梁和皮质骨密度十分重要,Zip14可能与肌少症与骨质疏松有关,但其具体机制尚待进一步研究。
肌肉生长抑制因子属于转化生长因子β超家族成员,主要在肌肉组织中大量表达,是肌肉增长的一种自分泌/旁分泌抑制因子,myostatin已被证明在骨骼肌发育中起重要作用。myostatin通过负向调节丝氨酸/苏氨酸蛋白激酶B途径、减少肌卫星细胞的数量等对肌量起负调节作用(图 1)。研究表明,肌少症患者血清中的肌肉生长抑制因子水平无明显改变,但局部肌肉中的生长抑制因子水平明显升高。成纤维细胞生长因子19(fibroblast growth factor,FGF19)亦可以由胞外信号调节蛋白激酶1/2(extracellular-signal-regulated protein kinase 1/2,ERK1/2)等其他激酶活化结节蛋白(tuberin)和激酶p90RSK(p90 ribosomal S6 kinsase),由mTOR信号通路来抑制肌肉萎缩。
IGF-1与受体结合通过PI3K促使PIP2向PIP3转化,正向调节丝氨酸/苏氨酸蛋白激酶B途径,进而增强下游的哺乳动物雷帕霉素靶蛋白活性,促进蛋白质合成,并且抑制FOXO去磷酸化进而影响蛋白质的分解;在TNF-α作用下,IKK磷酸化IκB,解除IκB对NF-κB的隔离作用,使得NF-κB进入细胞核,从而通过NF-κB信号通路增加蛋白质的分解;myostatin通过负向调节丝氨酸/苏氨酸蛋白激酶B途径、减少肌卫星细胞的数量等对肌量起负调节作用。
线粒体异常
线粒体是生物进行氧化代谢的主要场所,是生物体内氧化剂的主要来源,在氧化过程中,细胞内的酶促反应还会不断产生活性氧,少量的活性氧可以作为第二信使分子,调节多个基因的表达,参与代谢调节和应激抵抗,相反,如果活性氧过量产生以及有缺陷的氧化剂清除都会引起肌少症,根据线粒体自由基衰老学说(mitochondrial free radical theory of aging,MFRTA),线粒体DNA氧化损伤引起的功能障碍是衰老过程中的核心机制。由于线粒体DNA接近电子传递链,缺少保护性组蛋白,与核DNA相比不易修复,因而特别容易受到氧化损伤,此外,线粒体基因缺少内含子,使得每个突变都可能影响基因的完整性,从而影响蛋白质功能,线粒体中突变DNA不断积累,使得电子传递链复合物缺陷和线粒体膜电位破坏,线粒体释放促凋亡因子入细胞质,使得肌细胞凋亡,最终出现肌肉萎缩。此外,由于能量合成减少,细胞内腺苷一磷酸(adenosine monophosphate,AMP)增多,AMP可以增强AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK)活性,进而抑制mTOR活性,最终使得蛋白质合成减少。
人体内的线粒体总是在处于分裂与融合的动态平衡之中,这种动态平衡是依靠线粒体表面的蛋白来维持的。目前普遍认为老化时线粒体的这种动态平衡被打破,导致损伤与失去功能的线粒体大量积聚,最终会引起与衰老相关的疾病,近来有研究发现这与肌少症的发病相关。线粒体的融合包括外膜与内膜的融合,线粒体外膜的融合依靠线粒体融合蛋白(Mitofusins,MFN)的参与,而内膜的融合依靠于视神经萎缩因子1(optic atrophy 1,OPA1)。线粒体的裂解则依赖于发动蛋白相关蛋白-1(dynamin-related protein 1,DRP1)与线粒体表面的裂解同源蛋白(fission 1 homolog protein,FIS1)和线粒体分裂因子(mitochondrial fission factor,MFF)等受体的结合。Sebastián等在小鼠身上通过基因敲除等试验发现虽然衰老的过程中其MFN2也会减少,但肌少症的个体相比于正常个体其MFN2更低,并且MFN2的减低会抑制线粒体的自噬以及其质量控制,进而出现损伤线粒体的积累以及肌肉萎缩,此外Romanello等通过转染以及RNA干扰等技术发现DRP1与FIS1的升高会使线粒体分裂增加,从而可能激活AMPK-FoxO3途径导致蛋白分解增加,肌肉萎缩。OPA1在肌肉质量、代谢平衡和上皮衰老中具有重要作用。OPA1在肌少症中不断下降,肌肉特异性OPA1减少会改变线粒体的功能和形态,使肌干细胞减少,抑制蛋白合成,并且诱导萎缩相关基因的表达和降解蛋白的合成。
肌卫星细胞与自噬
肌肉干细胞中表达Pax7基因的干细胞又称之为肌卫星细胞,主要位于肌膜和基底膜之间,一般情况下处于静止状态,当受到损伤或刺激时即被激活并增殖,然后与原有骨骼肌细胞相互融合,形成新的肌纤维细胞。现在越来越来多的观点认为肌少症的发病与肌卫星细胞密切相关。随着人体衰老,肌卫星细胞所处环境发生改变并逐渐使其增殖能力降低,Bernet等发现,衰老的环境可以使肌卫星细胞表面的成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)损害并使得肌卫星细胞的p38α/β促分裂素原活化蛋白激酶(p38α/β mitogen-activated protein kinase,p38α/β MAPK)途径活性上调,从而抑制肌卫星细胞的增殖并最终导致肌少症的发生。同时,肌卫星细胞与许多成纤维细胞生长因子(fibroblast growth factor,FGF)密切相关。其中FGF2在推动肌卫星细胞的增殖过程中起着重要的作用,Rozo等发现衰老使得细胞外基质(extra cellular matrix,ECM)改变,ECM的改变使肌卫星细胞表面的β1-整合素(β1-integin)活性发生改变,这可能导致了肌卫星细胞对FGF2的敏感性下降,出现肌肉萎缩。
肌卫星细胞依赖于自噬从而保持静止状态,但其具体机制目前尚不明确。如果肌卫星细胞的自噬功能丧失,会使得损伤蛋白和功能丧失的细胞器(尤其是线粒体)集聚,进而活性氧(reactive oxygen species,ROS)大量增加导致肌卫星细胞的DNA损伤和衰老,肌卫星细胞中,ROS是促老化基因INK4a的关键调控因子,它可以使INK4a基因表达,肌卫星细胞衰老,最终出现数量和功能的丧失。
miRNA与遗传
miRNA是一种非编码的单链小分子RNA(microRNA),在进化上高度保守,通过翻译抑制调控基因表达。已经有许多学者通过试验证明,多种miRNA通过不同的机制抑制肌肉的萎缩,例如miR-23可以抑制肌肉环指蛋白1基因(muscle RINA Finger 1,MuRF1)和肌肉萎缩盒F基因(muscle atrophy F-box,MAFbx)的表达,miR-486可以下调FOXO1基因和磷酸酶和张力蛋白同源10号染色体上删除基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)的表达从而抑制肌肉的萎缩,miR-206可以抑制肌卫星细胞的增殖等。尽管miRNA在肌少症发病中所扮演的具体角色仍然有待进一步的研究,但至少目前的这些发现提示人们可以通过操纵miRNA的表达来对肌少症进行治疗。基因型检测和大规模遗传组学的研究可以为骨质疏松和肌量减少的风险因素及发病机制的研究提供线索。最近的综述总结了与肌量减少相关的最新基因型研究结果:目前已知TRHR、gremlin 1、GLYAT、GIMAP1、SERHL、PRDM16等基因与瘦组织量相关,其中TRHR、gremlin 1、PRDM16与全身瘦组织量相关,而GLYAT、GIMAP1与四肢瘦组织量相关。研究表明低瘦组织有很强的遗传性,且其遗传几率在50%以上,但是导致低瘦组织量的基因很大一部分是未知的,因此对导致低瘦组织的基因需要更进一步细致深入的研究。
综上,肌少症的研究尚处于探索阶段,其发病机制尚不十分清楚,目前的研究显示,增龄引起的肌少症主要与营养、运动、相关激素、炎症、线粒体异常、肌卫星细胞与自噬,以及遗传等因素有关。