肌少症影像学诊断方法及生物学标志
来源:CSOBMR 发布日期:2019-01-07 10:41:03浏览:2576次
作者:崔梦钊1 刚晓坤1 崔发英2 王尧3 崔海英1 左迪迪1 王桂侠1
单位:
1、吉林大学第一医院内分泌代谢科
2、吉林大学第一医院药学部
3、吉林大学第二医院骨科
摘要:肌少症是一类老年综合征,对于老年人的健康是一个严峻的挑战,将会导致老年人包括跌倒、骨折、感染、心血管疾病发生风险、代谢障碍、残疾及死亡等不良后果,因此明确肌少症诊断尤为重要。目前肌少症肌量减少的影像学诊断技术包括超声、CT、MRI、双能X线吸收仪(dual energy X-ray absorptiometry,DXA),以及人体成分分析、生物电阻抗等,生物学标志包括经肌肉接头、内分泌系统、炎症通路等几方面,本文将目前的诊断方法进行综述,分析各种方法的优缺点,以期为临床提供更好的诊断策略。
关键词:肌少症;影像学诊断;生物学标志
目前肌少症的定义尚未统一,普遍接受的定义为与年龄相关的、肌量的减少及肌力的下降和(或)体能表现的衰退,其与老年人减弱的体能、受损的心肺功能、残疾以及死亡相关。年龄相关的肌量减少主要是Ⅱ型肌纤维、运动神经元的减少以及肌肉脂质浸润。30岁之后肌量以每10年3%~5%的速度下降,而在60岁之后下降的速度明显加快。一项来自WHO的数据显示,年龄≥60岁的老年人,在2000年为6亿,预计到2025年达到12亿,2050年达到20亿。据推测,全球目前约有5千万人患肌少症,预计到2050年将高达5亿。目前已有多种指南对肌少症进行定义及诊断标准的阐述,包括EWGSOP(European Working Group on Sarcopenia in Older People)、IWGS(International Working Group on Sarcopenia)、FNIH(The American Foundation for the National Institutes of Health)以及AWGS(Asian Working Group for Sarcopenia),其中AWGS指南更符合亚洲人群的身体组成、遗传背景、种族特点等。据报道,按照AWGS标准,肌少症的患病率为6.8%~18.5%,并与性别、年龄、营养、运动、BMI、炎症、2型糖尿病、肿瘤等多种因素相关。在诊断方面,应用于临床的理想的筛查诊断方法应该安全、其诊断界值定义合理、经济实惠、更可行和可信、临床操作简便及高敏感性和特异性。目前有多种检查手段已被报道,影像学检查包括CT、MRI、超声、双能X线吸收测量法(dual energy X-ray absorptiometry,DXA)、人体成分分析、生物电阻抗(bioelectrical impedance analysis,BIA)等,生物学标志包括神经肌肉接头、内分泌系统、肌肉蛋白转化、行为介导通路、炎症介导通路以及氧化还原相关通路等几个方面。本文对目前诊断方法的研究进展进行综述,为临床提供确切的检查诊断依据,以利于肌少症的早期诊断与治疗。
影像学检查
CT
CT检查基于X线束的衰减特征以区分不同组织类型,同时也能评估脂肪浸润肌肉的程度,由于脂肪浸润骨骼肌源于肌肉力量和质量的减低,因此CT能够提供肌肉量的信息,以及肌肉成分的信息。尽管其准确度高,但也存在一些缺点:辐射大,需要患者在检查床上平躺一段时间,此外,价格较高,在某些小型医疗机构不能完成。
MRI
MRI是另一种具有高分辨率的影像学技术,能够清晰地鉴别不同的组织类型,并基于各解剖部位的化学分子构成,如脂肪细胞、胶原和弹力纤维、成纤维细胞和毛细血管,来评估肌间脂肪组织,与CT一样,通过评估脂肪浸润肌肉的程度来提供肌肉量的信息。关于MRI的不足,价格相对高,需要患者良好的配合,检查时间较长,可能会导致幽闭恐惧症的发作,且需屏住呼吸以减少呼吸运动引起的伪影,由于噪音大需要戴耳塞,还有某些铁磁性植入物如起搏器或金属假肢等是MRI的禁忌证。
超声
超声简便易行,较易于应用于临床实践或者大型人口调查。它是一个普查工具,不受卧床或活动受限者的限制,超声能估测肌肉量是由于强回声代表脂肪浸润及间质纤维化的程度,但不能准确测量肌肉量。也有研究报道借助计算机辅助灰阶分析肌肉回声强度,但是在肌少症领域中的经验还很不足。超声检查还依赖于技师的经验与技术,因此其结果可重复性低。
BIA
BIA无创,并且对于身体组成的测量是充分验证的,具有执行速度快、便于床旁应用、没有射线辐射、花费小、操作简单的优点。BIA测定了通过人体的低强度、固定频率的交流电阻抗。由于阻抗与人体总含水量呈负相关,传导能力与水的含量、组织中电解质含量成正相关,因此BIA可测定总肌肉量的多少,因为体内水含量最丰富之处即是肌肉。当然,也存在缺点,其测量会受含水量的影响,如为水肿状态会干扰肌肉量的测量,还有环境温度、近来的身体活动、检查前过多的饮食摄入、以及检查过程中电极的位置等均可影响其准确性。
人体测量术
人体测量术是一种较为简单的技术,易于应用于临床实践及大规模人口调查中。皮褶厚度用来评估人体脂肪含量,肢体周径反应肢体肌肉及蛋白质营养状态。但是也存在不足:首先观察者间差异会影响检查的敏感性;其次,皮褶厚度的测量只能测皮下脂肪而非内脏脂肪,而内脏脂肪是某些疾病情况下的独立危险因素,如糖尿病、心血管疾病以及肿瘤等。与年龄相关的人体脂肪分布变化、老年人皮肤弹性差以及缺乏统一的界值使得人体测量术对于肌肉量的评估缺乏准确性。
DXA
DXA是人体成分在分子水平的标准诊断方法,它基于“三部分”模型:即脂肪量、肌肉量及矿物盐含量。DXA能测量通过人体的两种不同能量的X射线的相对衰减,其原理为:X射线的衰减随光电子能量增加而减少,低密度的组织(如软组织)允许更多的光电子穿过,因此它们比高密度的物质(如骨)衰减少。对于每一种组织两种X射线能量峰值衰减的差异是特定的。DXA能评估R值,其是指两种不同能级衰减系数的比值。软组织的R值因软组织的组成不同而不同,脂肪比例越高,R值越低。DXA分析X射线在软组织和骨中的衰减以及X射线只在软组织中的衰减,由此能评估出脂肪、肌肉及骨量。
最新一代的光密度计(densitometers)对全身扫描以评估身体组成,具有低辐射的优点,全身扫描射线剂量<1 mrem,因此DXA对于反复测量身体组成是较为安全的选择。DXA检查所花时间较短,全身扫描一般<20 min。另外,DXA能测定三种成分含量并能提供每一种成分的局部含量,主要是四肢骨骼肌肉量(appendicular skeletal mass,ASM),包括上、下肢瘦软组织,主要指肌肉,其准确性很高,目前ASM作为评价肌少症的诊断标准。
DXA的缺点:有研究报道体内残留的造影剂可能会产生伪影进而影响DXA的准确性。此外,在肥胖患者中,DXA测量的准确性会被射束硬化(beam hardening)这一现象干扰,是由于当多种能量的X线穿过人体时,光子衰减取决于各自的能量,低能量的光子比高能量的光子衰减的多。因此,组织越厚,低能量光子的衰减越多,导致更大平均能量频谱的变形。在多数情况下,这种效应已被光密度计合理的校正减小了,但是在体形肥大的人中可能导致人体脂肪量被低估。另外,体内严重的水肿或大量腹水情况,将导致DXA的显著误差。综上,DXA不适用于造影剂或放射性元素的存在、体重过大以及体内水量过多患者。由于暴露辐射的致畸作用,DXA惟一禁用于妊娠患者,即便辐射量很小。此外,DXA设备不便携,限制了其在大规模流行病学研究的应用,在基层医疗机构中较难获得。另外,DXA不能测量肌间脂肪组织,无法区分内脏、皮下及肌间脂肪,也将影响肌肉量的评估。而且各制造商之间的差异使得不同扫描仪难以得出具有统一标准的结果。
综上,CT、MRI、DXA,其诊断肌少症的准确性较高,但需依赖专业检查人员的经验及技术手法,并且需有较大医疗平台支持。而超声、人体测量学及BIA,他们操作简便,在基层医疗中能够发挥作用,但是因其准确性低,限制了肌少症的诊断应用于临床实践。肌量测定应首选DXA,也可根据实际情况选择MRI、CT或BIA测量。各项影像学方法的肌量诊断阈值:低于参照青年健康人峰值的-2SD即为肌量减少。
生物学标志
除影像学手段外,基于肌少症病理生理机制的检测肌肉量的生物学标志(图 1),通过对体液进行检测,能够应用于肌少症的临床监测及管理中,同时,该种检测能提高公众对肌少症的重视,以发现疾病、治疗疾病。
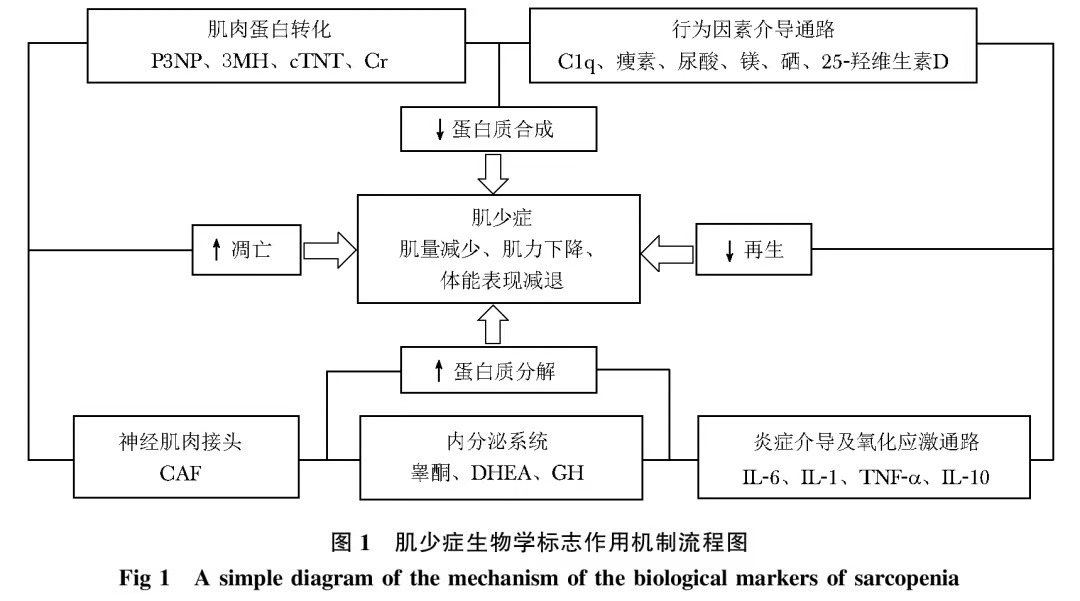
内分泌系统
肌少症表现为多种激素水平的降低,尤其是性激素[如睾酮、脱氢表雄酮(dehydroepiandrosterone,DHEA)]、生长激素(growth hormone,GH)以及胰岛素样生长因子1 (insulin-like growth factor-1,IGF-1)。睾酮促进肌肉蛋白质的合成,而男性30岁之后睾酮水平每年减少1%。有研究报道睾酮的补充减少了肌肉量和握力的下降。然而,老年男性的力量提高是由于补充较大剂量的睾酮,由此产生的潜在风险如睡眠呼吸暂停、血栓形成及增加的前列腺癌发生风险,弊大于利。DHEA由肾上腺皮质分泌,是调节肌肉生长的重要雄激素。DHEA随年龄逐渐减少,提示其在肌少症的发病机制中起重要作用。它对于人体成分及体能表现起到保护作用,然而有研究报道合成代谢类激素与肌力的下降无明显关联。GH是由垂体前叶产生的单链多肽,与睾酮相似,30岁以后GH水平每年下降1%,每日GH分泌水平与年轻人相比,下降5~20倍不等。这种年龄依赖的GH的下降是继发于GHRH的下降以及生长抑素分泌的增加。GH的促生长作用是由循环中或局部产生的IGF-1介导,其是一个有效的合成代谢的激素,能够刺激肌肉生长和再生。已被证明IGF-1全身给药促进外伤后骨骼肌功能恢复。
神经肌肉接头
肌少症的病理生理机制之一为神经生理功能损害,其与神经肌肉接头的功能障碍似乎相关。神经肌肉接头参与肌肉动作电位的转导,其功能障碍将导致运动时这一过程的逐步改变,并与神经肌肉疲劳有关。因此,在老年人中将导致难以完成持续的运动。已有研究报道,神经肌肉接头功能障碍是由于集聚蛋白的裂解增加,集聚蛋白是一种由运动神经元产生的蛋白质,能够激活肌肉特异的酪氨酸激酶受体,进而能稳定乙酰胆碱受体(acetylcholine receptor,AcHR)。然而神经胰蛋白酶能够裂解集聚蛋白,产生羟基端集聚蛋白片段(C- terminal agrin fragment,CAF,血清中可测)而且导致AcHR不稳定。有研究已显示肌少症患者中CAF水平高于非肌少症者。然而有研究表明循环中CAF水平与神经肌肉疲劳呈负相关。
肌肉蛋白转化
在肌肉重塑的阶段,Ⅲ型胶原蛋白对于提供正确位置的结构基础及成肌细胞的发育起重要作用。Ⅲ型胶原蛋白是由其前体—前Ⅲ型胶原蛋白的N和C端裂解而合成,而其N端肽(N-terminal peptide,P3NP)释放入血清。P3NP作为胶原合成的产物,它反应了肌肉重塑的方式,而不像其他指标如睾酮、生长激素和IGF-1等只代表激素水平,并未反映合成代谢的过程。因此,P3NP在血清中可测,并且它对于激素(如睾酮和GH)的合成应答是一个有用的标志物,它可能与四肢肌肉量的变化相关。
3-甲基组氨酸(3-Methylhistidine,3MH)是另一种在肌少症的病理生理过程中起作用的分子。它是由肌动蛋白和肌球蛋白的组氨酸残基的甲基化而来,并且能够诱导肌源纤维的蛋白水解。3MH在尿或血清中都可测,但需要患者在采集血样或尿样前3天禁食肉类,因为肉类会影响结果。它的潜在生物学标志作用被一项研究所支持:标记为非放射性同位素的3MH给健康人口服给药,第2天采集尿样及血样,并通过质谱分析法分析,以获得肌源纤维蛋白水解的信息。
骨骼肌特异的表型肌钙蛋白T,可能用作肌肉消耗的标志物。通常微量肌钙蛋白在循环中存在,表示为正常肌肉转化或微小损害。血中大量肌钙蛋白的存在是肌肉损害的标志。骨骼肌被多层结缔组织包围,因此这些细胞膜的破坏解释了血清中肌钙蛋白的存在,尤其是cTNT(Cardiac muscle-specific isoform of troponin T),其代表了病理状态。有研究发现,社区老年人在10周的力量训练后,体能有明显改善,同时有血清cTNT水平下降2倍,提示了其在肌少症中的生物学标志作用。
血清肌酐水平一直被认为是评价骨骼肌状态的指标。它具有高获得性、价格低的优势,对老年肌少症患者的评估占重要角色。肌酐作为肌少症的一个指标的评估未来将被扩展,通过口服D3肌酸后,用同位素质谱法检测尿肌酐水平,尿肌酐的测定提供了其前体—肌酸的估计,在人体中,肌酸几乎全部来源于横纹肌。由于肌酐排泄在一天中有波动,因此需要患者禁食肉类。
炎症介导通路以及氧化还原相关通路
众所周知,脂肪组织与肌少症相关,脂肪组织分泌大量的促炎症细胞因子,如白介素6(interleukin-6,IL-6)、白介素1(interleukin-1,IL-1)以及肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),都被发现与老龄化进程相关,由此与肌少症相关。这些细胞因子可降低老年人体能表现及肌力,甚至残疾。IL-6,一种促炎症因子,是肌细胞因子之一,它是由1型和2型肌纤维于体外分泌,高水平的IL-6与抗炎症因子如IL-10的减少有关。这表明肥胖或糖尿病的老年患者发展为肌少症性肥胖,表现出持续而显著的促炎症因子如IL-6的升高,提示内分泌代谢与炎症反应之间的微妙联系。此外,已被证明炎症因子如TNF-α以及IL-1,仅在激活素上调时能够阻断成肌细胞的分化。这种协同的激活素—炎症因子轴在年龄相关的肌少症模型中已被证实。另一种潜在的肌少症生物学标志是丁酰胆碱酯酶(butyrylcholine esterase,b-CHE),是由肝脏合成的α糖蛋白。最近已被阐明b-CHE是慢性炎症及营养不良的常规标志物,与老年人握力和肌量呈线性相关。
行为因素介导的通路
行为因素,如体能活动程度、营养状态及肥胖,在肌少症的发病中很重要。一些生物学标志受体能活动的程度影响。年龄诱导的补体蛋白C1q分泌的增加,是通过激活肌肉的Wnt信号通路,进而导致肌纤维的发育。已被研究证实血清C1q水平反应了老年人肌肉量和肌力的下降,并且对渐进的体能训练进行应答,表明抗阻力运动对肌少症起保护作用。营养因素对于肌少症的发生发展也很重要,营养不良的生物学标志会帮助识别这一状态。贫血的存在同时有低血清白蛋白或硒,与老年人下降的肌肉量和肌力相关。
瘦素由脂肪细胞产生,并对骨骼肌有作用,特别是调节脂类分解及胰岛素敏感性。瘦素受体是由瘦素本身下调的,而胰岛素抵抗参与此调节中。在肌少症中被发现存在瘦素受体的下降以及肌肉量的减少,以及循环中瘦素的增加。这种瘦素与肌少症之间的平行关系支持了假说:瘦素可能主要参与肌少症性肥胖,而不只是单纯性肥胖。外源性瘦素已被证实能够减少肌细胞的蛋白质合成。此外,瘦素能够引起炎症反应,也负向调节IGF-1和睾酮,二者是广为熟知的参与肌少症中的因子。高血尿酸水平在握力较高的老年男性、女性中发现,并且较高的血镁和体能表现指数如小腿体力和握力之间的正向关系已被证实。此外,低25-羟维生素D水平不仅与老年人的低体能表现有关,而且与肌肉代谢和肌量减少有关,最终导致肌力下降。
基于以上生物学标志在肌少症发病机制中的重要意义,可在诊治过程中合理应用各项指标对肌少症的治疗效果进行监测。例如,贫血、低血白蛋白、微量元素缺乏(低镁、低硒等)、低25-羟维生素D者,在合理膳食、外源补充蛋白质或维生素D后,定期复查血相关指标。睾酮缺乏者,给予小剂量睾酮补充后,定期监测睾酮水平。在进行力量训练后,定期监测cTNT水平。此外,可测血清中P3NP水平反映肌肉重塑情况,血、尿3MH反映肌纤维蛋白水解情况。同时复查四肢肌肉量,明确治疗是否有效,是否需要进一步治疗,以上应用对于预防老年人摔倒、骨折,增加肌肉强度等有重要价值。目前尚有一些生物学标志物在研究中,以期早日应用于临床,为肌少症的诊治提供新策略。
综上,肌少症的诊断方法包括影像学检查以及生物学标志两方面,目前影像学检查以DXA为优势检查方法应用于临床,生物学标志包括一些潜在标志物尚在研究中。对于60岁以上的老年人,行相关检查筛查肌少症并合理干预对提高老年人的生活质量至关重要,因此,选择合理的诊断方法也是每个医生的首要任务,以早期诊断、早期干预,延缓疾病进展。