骨质疏松性椎体压缩性骨折诊疗与管理专家共识
来源:CSOBMR 发布日期:2018-11-06 14:49:35浏览:5227次
中华医学会骨质疏松和骨矿盐疾病分会
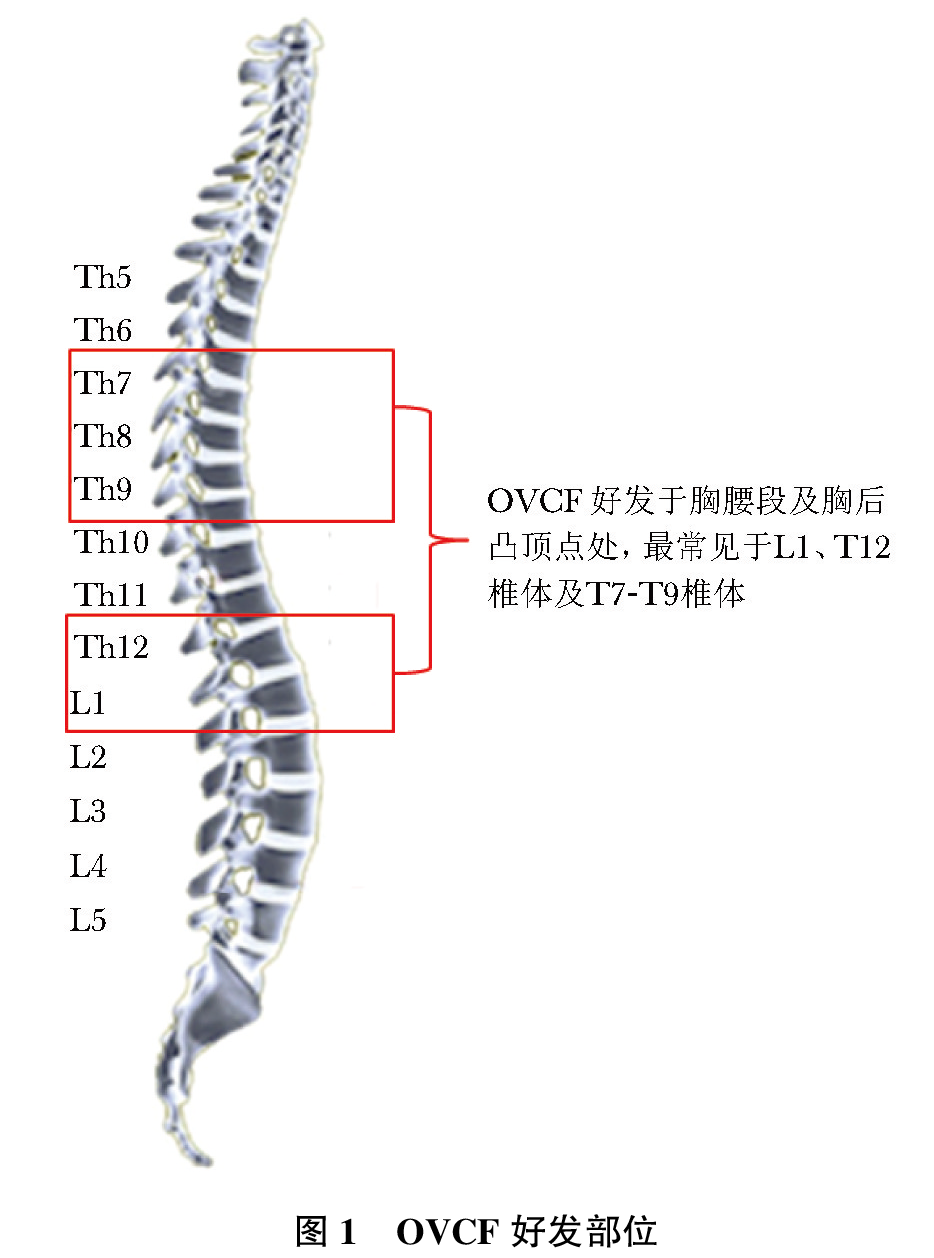
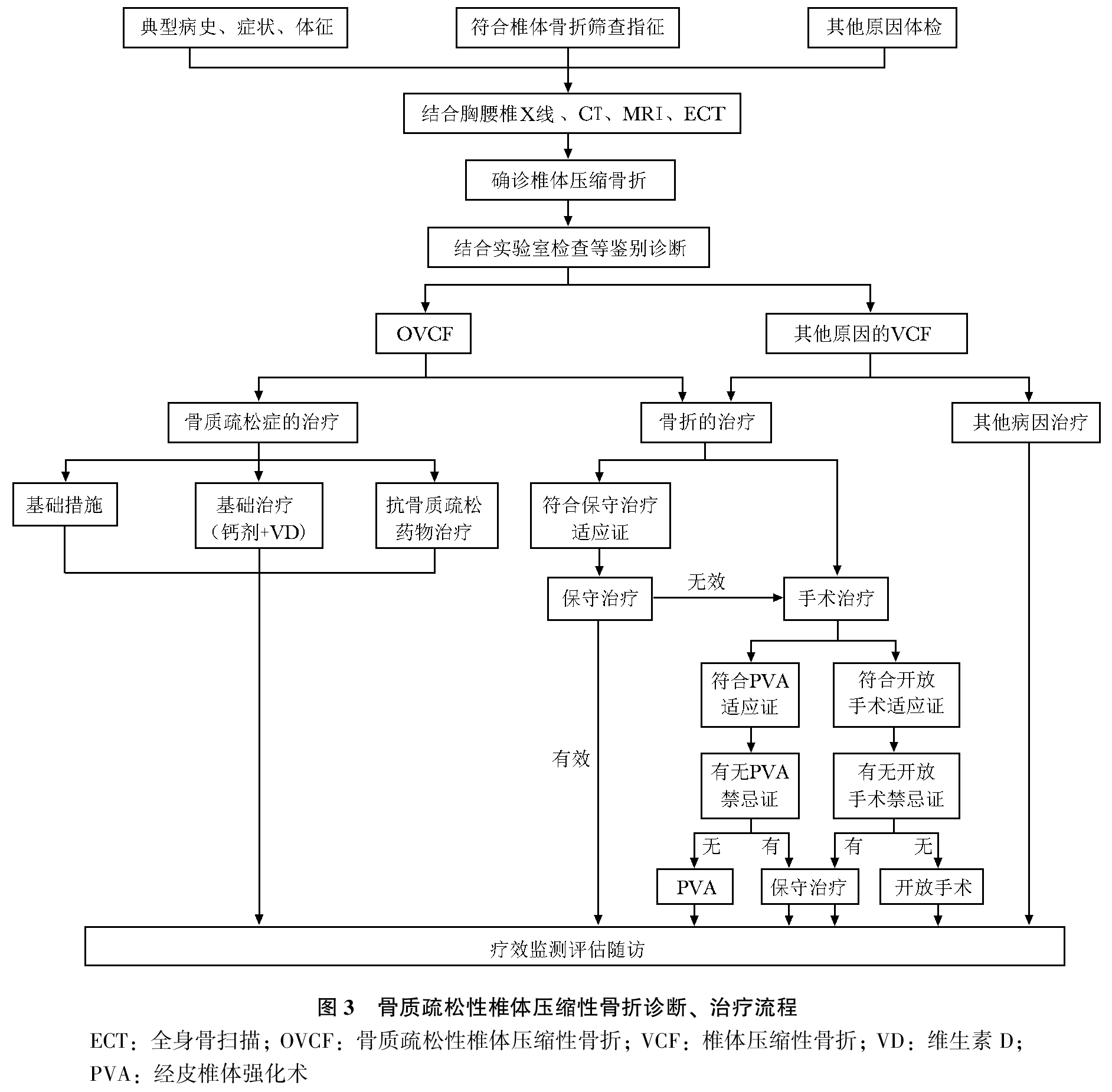
骨质疏松性椎体压缩性骨折(osteoporotic vertebral compression fracture,OVCF)是指由骨质疏松症导致椎体骨密度(bone mineral density, BMD)和骨质量下降、骨强度减低,在轻微外力甚至没有明显外力的作用下即发生的骨折,是最常见的骨质疏松性骨折(脆性骨折)类型。临床上以胸/腰背部疼痛为主,伴或不伴下肢神经症状为主要临床表现。 概述 OVCF流行病学 骨质疏松症每年引起全球范围约890万例患者发生骨折,平均每3秒发生1例次,50岁以上约1/3的女性和1/5的男性将会发生骨质疏松性骨折。椎体是最常见的骨质疏松性骨折发生部位,约50%以上骨质疏松性骨折发生于椎体,好发于胸腰段。2017年我国流行病学研究显示,北京绝经后女性影像学椎体骨折的患病率随年龄增加,50~59岁患病率为13.4%,80岁以上高达58.1%;北京另一项研究显示,2000年,椎体骨折患病率50~59岁为15%,80岁以上为36.6%。一项应用模拟模型研究显示,我国2015年50岁以上人群,新发OVCF约为127万例;预计到2020年,将达到约149万例;到2050年,则可高达约300万例。 OVCF诊疗现状 OVCF发生隐匿,约半数患者无明显背痛症状,就诊率低。此外,临床医师可能忽视胸腰椎侧位X线等影像学检查的必要性和重要性,放射科医师对影像学椎体压缩性骨折的漏报均造成了OVCF和骨质疏松症的诊治率过低。国外研究显示约40%的椎体骨折存在影像学漏报;国内一项研究针对1 638例住院患者的胸腰椎侧位影像分析(采用Genant半定量方法),发现OVCF患者84例,而X线影像学报告诊断为OVCF者仅30例,漏报率高达64%。OVCF存在明显的诊治率不足,需在临床工作中重视OVCF的筛查,及时诊治。 OVCF社会经济学 随着人口老龄化,OVCF患病率将不断上升,导致社会经济负担也大大增加。研究显示,美国每年耗资138亿美元用于支付椎体骨折的医疗费用,而瑞典的治疗费用每年达7.1亿美元。中国2010年用于治疗OVCF的医疗费用约100亿美元;预计到2035年,每年支出费用将达到约170亿美元;而到2050年预计医疗费用支出将高达约220亿美元。由此可见,OVCF为国家、社会和家庭带来沉重经济负担。 OVCF临床表现 症状 OVCF因骨折严重程度、骨折部位和病程不同,临床症状轻重不一。主要表现如下: 1.腰背部疼痛:为OVCF最主要的临床表现,也是患者就诊的主要原因。通常表现为急性或慢性持续性腰背部疼痛,可伴胸肋部放射性疼痛。 (1) 急性期:患者在骨折后出现腰背部急性疼痛,大部分患者在卧床休息时背痛消失或明显缓解,但在脊柱承担负荷时(如翻身、坐起、改变体位或行走等)出现疼痛或者疼痛加重。 (2) 慢性期:部分患者表现为长期慢性腰背部疼痛,可能是由于骨质量较差,微骨折发生所致。另有部分患者在骨折发生后过早下床负重活动,导致骨折愈合不良、假关节形成,也可以导致长期慢性疼痛。 (3) 沿神经分布区走行的放射痛:OVCF患者的疼痛不仅包括骨折部位的局限性疼痛,还会沿相应神经分布区出现放射痛。胸椎压缩性骨折患者除了背部疼痛,通常伴有肋间神经放射,表现为胸前区或肋弓处疼痛。腰椎压缩性骨折的患者除了腰部局限性疼痛,可伴有腹前区放射痛或下肢放射痛及木胀感(沿股神经或坐骨神经放射)。 (4) 肌肉痉挛和抽搐:患者长期采取最小疼痛的体位,常导致腰背部肌肉张力增高,造成肌肉痉挛,当患者翻身、坐起或改变体位时可发生肌肉抽搐。腰背部肌肉长时间痉挛易导致肌肉疲劳,可引起远离骨折部位的疼痛及压痛。 2.其他临床表现:部分患者胸腰椎压缩性骨折时胸廓容积减小、肺活量下降,导致肺功能显著受限。部分患者脊柱后凸畸形加重,增大了肋弓对腹部的压力,患者可产生饱胀感,造成食欲减退。部分患者还会出现腰椎前凸增大、椎管狭窄、腰椎滑脱等表现。 体征 1.腰背部压痛、叩击痛:骨折后患者通常急性腰背痛的压痛点多在棘突部位。患者可伴有胸腰椎后凸/侧凸畸形,并进行性加重。 2.脊柱后凸畸形:严重的椎体压缩骨折,尤其是多发性椎体骨折可致脊柱后凸畸形,患者出现驼背和身高变矮。部分患者在骨折后因无明显疼痛不适而未诊治或自行镇痛治疗,常导致骨折椎体持续性压缩变扁,进展形成脊柱后凸畸形。伴有胸腰椎交界节段骨折和上终板骨折的骨质疏松性椎体骨折者发生严重后凸畸形的风险更高。 3.神经损害体征:一般无神经损害表现,但如果骨折程度严重,也可出现下肢感觉减退、肌力减弱及反射改变等神经功能损害表现。 OVCF筛查 OVCF患者病情多较为隐匿,大多数在无明显外伤或仅有轻度外伤(如扭伤、平地滑倒等)情况下,甚至仅仅是日常生活动作如咳嗽、喷嚏、弯腰等即可引起骨折。骨折好发于胸腰段及胸后凸顶点处,最常见于L1、T12椎体及T7-T9椎体(图 1)。为提高OVCF的诊治水平,减少疾病漏诊,建议对高危人群开展OVCF筛查。2017年中国《原发性骨质疏松症诊疗指南》行胸腰椎侧位X线影像或DXA侧位椎体骨折评估(vertebral fracture assessment, VFA)筛查指征见表 1。 OVCF诊断与鉴别诊断 OVCF的诊断需要结合患者病史、临床表现和影像学证据作为判定标准。 影像学检查 影像学检查是诊断OVCF的主要手段。 1.X线:胸腰椎X线侧位影像可作为判定OVCF首选检查方法。常规胸椎、腰椎X线侧位摄片范围应分别包括T4至L1和T12至L5椎体。椎体压缩骨折时,有楔形或“双凹征”改变,伴骨小梁稀疏。部分可表现为椎体内“真空征”,有假关节形成。基于胸腰椎侧位X线影像并采用Genant目视半定量判定方法,椎体压缩性骨折分型(图 2):①在原椎体高度上压缩20%~25%为轻度压缩骨折;②在原椎体高度上压缩25%~40%为中度压缩骨折;③在原椎体高度上压缩>40%为重度压缩骨折。通常轻度椎体压缩性骨折患者易被漏诊,对于有高危因素或明显临床症状的患者需要有经验的放射科医师协助判断。 2.双能X线吸收检测法(dual energy X-ray absorptiometry,DXA):利用VFA可显示脊柱T4-L4侧位像,并利用其判断椎体骨折的类型和程度。VFA诊断椎体骨折的敏感性和特异性与X线半定量技术相一致。 3.CT:能够明确椎体周壁是否完整,椎体后缘是否有骨块突入椎管,以及椎管受累程度,能发现X线片不能发现的骨皮质中断。 4.MRI:广泛地应用于骨质疏松性骨折的诊断,具有重要价值。①对X线及CT都不能明确诊断的髓内骨折(微骨折),MRI可依据髓内出血、水肿导致含水量的变化通过信号异常敏感地反映出来;②MRI及其脂肪抑制技术可用于判定责任椎体,尤其是在多发椎体呈楔形变时;③可同时显示骨骼及周围的软组织病变,用于鉴别骨质疏松性骨折与骨肿瘤等引起的病理性骨折及其他疾病。 5.全身骨骼核素成像:可提示骨折椎体放射性核素浓聚。如患者不能进行MRI检查时,可作为替代方法。 BMD测定 已经发生OVCF者,即可做出骨质疏松症的诊断,并不依赖于BMD测定结果。但仍然推荐对OVCF患者进行BMD测定,以便于后续病情判断和疗效监测评估。 实验室检查 基本检查包括血、尿常规,肝、肾功能,血钙、磷和碱性磷酸酶等。 1.选择性项目:红细胞沉降率、血清25羟维生素D、甲状腺功能、甲状旁腺素、C反应蛋白、血清或尿蛋白电泳及肿瘤标志物等。 2.骨转换生化标志物:可通过检查骨转换生化标志物(bone turnover marker, BTM; 包括骨形成和骨吸收标志物),了解骨代谢情况,评估病情进展,判断再骨折风险,并可作为后续抗骨质疏松药物疗效评估监测的基线。国际骨质疏松基金会(International Osteoporosis Foundation,IOF)推荐首选血清Ⅰ型原胶原N-端前肽(procollagen type 1 N-terminal peptide,P1NP)和血清Ⅰ型胶原交联C-末端肽(serum C-terminal telopeptide of type 1 collagen, S-CTX)分别作为骨形成和骨吸收的敏感指标。 鉴别诊断 1.OVCF与其他因素导致的椎体压缩性骨折的鉴别:引起椎体压缩性骨折的常见病因包括骨质疏松症、创伤和肿瘤(包括原发骨肿瘤、浸润癌和转移癌)等,其中骨质疏松症引起的椎体压缩性骨折最为常见。X线、CT及MRI图像均有助于鉴别OVCF和其他原因所致椎体骨折。此外,OVCF还需同时排除继发性因素引起的骨质疏松症,具体可参考2017年中国《原发性骨质疏松症诊疗指南》。原发性骨质疏松症患者通常血钙、磷和碱性磷酸酶水平在正常范围内,骨折患者骨转换标志物水平可正常或轻度升高。 2.腰背部疼痛的鉴别:OVCF患者背部疼痛轻重不一,需与腰肌劳损、椎间盘和小关节退化等病因引起的背部疼痛相鉴别。通常OVCF患者腰背部疼痛在活动及体位变化时加重,且常伴有脊柱后凸畸形,压痛点多位于棘突部位。 3.责任椎体的判定:根据影像学、BMD、实验室检查及患者病史、症状体征,一般可明确OVCF诊断。无论是多节段椎体骨折还是单椎体骨折,都应确认引起疼痛的骨折椎体即疼痛责任椎体。明确疼痛的责任椎体有助于指导椎体骨折的处理方案。一般责任椎体节段局部叩压痛明显,MRI显示相应椎体有水肿信号。对无法行MRI检查的患者,可行骨核素显像与增强CT结合检查,如显示相应节段椎体放射性核素浓聚及CT显示骨折征象,可判定为疼痛责任椎体,即需基于患者临床表现、影像学表现及两者吻合程度判定责任椎体。OVCF诊断、治疗流程见图 3。 OVCF治疗 OVCF的治疗原则是复位、固定、功能锻炼和抗骨质疏松治疗。 骨折的治疗 应根据患者年龄、并发症、骨质疏松程度而定,以尽快缓解疼痛、恢复患者活动功能为主要原则。OVCF以中老年人多见,复位和固定应以方法简便、安全有效为原则,以尽早恢复正常生活质量为目的;应尽量选择创伤小、对功能影响少的方法,着重于功能恢复。 在OVCF症状控制及康复治疗的同时,须重视骨质疏松症本身的治疗。无论保守治疗还是手术治疗,都需与抗骨质疏松治疗结合,才能从根本上提高骨量及骨强度,避免发生再骨折。 1.非手术治疗:①目的:缓解疼痛,早期恢复活动,维持脊柱的稳定; ②适应证:适用于症状较轻,影像学检查显示为轻度椎体压缩骨折,无神经压迫,无稳定性受损或不能耐受手术者。 急性期的综合管理包括短期卧床休息、药物镇痛、脊柱支具、早期恢复下床活动、抗骨质疏松药物等。OVCF的急性期镇痛可首选口服镇痛药并按照世界卫生组织(World Health Organization,WHO)镇痛阶梯递进治疗,也可考虑联用降钙素;在疼痛控制后,可考虑在脊柱支具保护下开始适度的早期下床活动。 对采用保守治疗的患者,应密切观察。如果保守治疗效果不满意,骨折愈合不良,导致假关节形成、椎体进一步塌陷、脊柱畸形甚至脊髓压迫(如出现截瘫)、疼痛持续不缓解、日常活动受限、生活质量下降,则应及时考虑手术治疗。 2.手术治疗 (1) 微创手术:目前最常用的微创手术治疗方法包括经皮椎体成形术(percutaneous vertebroplasty, PVP)和经皮后凸成形术(percutaneous kyphoplasty, PKP),二者均属于经皮椎体强化术(percutaneous vertebral augmentation,PVA)的范畴。不建议将PKP及PVP作为预防性手段用于严重骨质疏松患者,亦不能替代抗骨质疏松药物治疗骨质疏松症。 PVA适应证:①保守治疗效果不满意的疼痛性OVCF(指使用镇痛药后疼痛缓解不明显或使用剂量可能引发过度的镇静、意识模糊、便秘等不良反应);②不稳定的椎体压缩骨折;③椎体骨折不愈合或椎体内部囊性变、椎体坏死(Kummell病);④不宜长时间卧床的患者,高龄患者宜考虑早期手术,可有效缩短卧床时间,减少并发症的发生;⑤伴后凸畸形的OVCF建议选用PKP。 绝对禁忌证:①无症状性OVCF;②手术节段的局部感染及无法控制的全身感染;③严重的无法纠正的凝血功能障碍;④不能耐受手术者;⑤对PVA器械或材料过敏者。 相对禁忌证:①OVCF已造成神经根、脊髓损伤;②有结构因素限制工作通道的操作,如椎弓根骨折、极重度椎体压缩性骨折;③有出血倾向者;④身体其他部位存在活动性感染者;⑤与椎体压缩骨折无关的神经压迫引起的根性痛。 相对于保守治疗,目前大多数研究及Meta分析均支持PVA手术能够改善患者功能、生活质量,尤其对于老年疼痛性OVCF患者,微创手术治疗能缩短住院时间、降低再入院率和病死率。PVA的手术时机目前尚无定论,有研究支持早期应用PVA更有利于患者的远期预后。 目前关于PVA是否会增加再发骨折发生率尚无一致的研究结论,但有效的抗骨质疏松治疗,可有效减少再骨折发生率。 (2) 开放手术:OVCF严重的后凸畸形及椎体后壁碎骨块向后方压迫可造成脊髓压迫与神经损伤,对有神经、脊髓压迫症状和体征、严重后凸畸形、需行截骨矫形以及不适合微创手术的不稳定椎体骨折患者,可考虑行开放手术治疗进行减压内固定。术前需要评估患者心肺功能及对手术的耐受力,术中可采用在椎弓根螺钉周围局部注射骨水泥、骨水泥螺钉、加长和加粗椎弓根钉、可膨胀椎弓根螺钉、皮质骨轨迹螺钉或适当延长固定节段等方法增强内固定的稳定性。 骨质疏松症的治疗 OVCF的病理基础是骨质疏松症,骨折后应积极采取规范的抗骨质疏松药物治疗,以缓解疼痛、抑制急性骨丢失、提高骨强度、改善骨质量,减少再次骨折。 1.基础措施: (1) 健康的生活方式:戒烟、减少饮酒,富含钙质、低盐和适量蛋白质的均衡膳食,减少咖啡和碳酸饮料的摄入,多晒太阳和适当户外运动,慎用不利于骨健康的药物等。同时,应避免过度负重和身体过度扭曲等。 (2) 预防跌倒:跌倒是导致骨质疏松性骨折的重要原因,避免跌倒是预防骨折的有效措施,包括识别跌倒的危险因素(如环境因素、健康因素、神经肌肉因素等)及采取预防跌倒的相关措施(如改善视力、减少或避免服用影响神经功能的药物、在容易滑倒的地点增加扶手、使用保护器等)。 2.基础治疗: (1) 钙剂:50岁及以上骨质疏松患者,推荐补充元素钙每天1 000~1 200 mg。尚无充分证据表明单纯补钙可替代其他抗骨质疏松药物治疗。 (2) 维生素D:充足的维生素D水平能够提高患者对抗骨质疏松药物治疗的疗效,利于骨折愈合。推荐成人维生素D摄入量为400 IU/d,65岁及以上老年人推荐600 IU/d,可耐受最高剂量为2 000 IU/d;用于骨质疏松症防治剂量可达1 000~1 200 IU/d。 钙剂与维生素D需要与抗骨质疏松药物联合应用,并贯穿整个治疗过程。临床应用中应该注意个体差异和安全性,定期检测血钙和尿钙,酌情调整剂量。 3.抗骨质疏松药物干预:抗骨质疏松药物最重要的作用是维持或增加BMD,改善骨强度,降低不同部位的骨折和/或再发骨折风险。根据骨质疏松严重程度和骨折风险,注重个体化原则,综合考虑药物的适应证和禁忌证、临床疗效、安全性、经济性和依从性等因素,合理选择药物。 (1) 双膦酸盐类药物:双膦酸盐类药物是强有效的骨吸收抑制剂,包括阿仑膦酸钠、利塞膦酸钠、唑来膦酸、伊班膦酸钠等,这些药物在骨质疏松人群中均具有比较充分的循证医学证据,其中部分药物可使发生椎体骨折的患者再发骨折风险降低(表 2)。 双膦酸盐药物安全性:双膦酸盐药物整体安全性良好,少数患者口服双膦酸盐可能发生轻度胃肠道反应,包括轻度上腹疼痛、反酸等食管炎和胃溃疡症状。因此需要严格按照说明书服用药物。 当患者肌酐清除率低于35 mL/min时,禁用静脉双膦酸盐,不推荐使用口服双膦酸盐。使用双膦酸盐前,需评估患者肾脏功能。 下颌骨坏死(osteonecrosis of the jaw, ONJ)和非典型性股骨骨折(atypical femur fracture, AFF)均较罕见,多见于长期、大剂量使用双膦酸盐的患者。高危人群或长期使用的患者应定期随访。 (2) 选择性雌激素受体调节剂(selected estrogen receptor modulators, SERMs):SERMs临床主要使用雷洛昔芬。研究提示雷洛昔芬治疗36个月,可使既往有椎体骨折患者再发椎体骨折风险降低30%,既往无椎体骨折患者椎体骨折风险降低50%,但并不能降低非椎体骨折风险。常见不良反应包括潮热、下肢痉挛、深静脉栓塞。 (3) 雌激素类:雌激素类药物临床剂型包括雌激素、孕激素以及雌孕激素复合制剂。研究发现雌激素补充治疗5年可降低临床椎体骨折风险34%,降低髋部骨折风险34%,降低其他骨折风险23%,但尚无在OVCF人群中应用降低骨折风险的证据。雌激素类药物治疗应严格掌握适应证和禁忌证,绝经早期开始使用(60岁以前或绝经不到10年)患者受益更大。使用最低有效剂量,定期进行(每年)安全性评估,特别是针对乳腺和子宫。 (4) 降钙素:降钙素临床上有鲑鱼降钙素和鳗鱼降钙素。5年研究提示鼻喷鲑鱼降钙素200 IU/d可降低椎体骨折风险33%,可使既往有椎体骨折患者再发椎体骨折风险降低36%,但不能降低非椎体或髋部骨折风险,而且更高或者更低剂量对椎体骨折风险亦无降低作用。关于降钙素预防骨折后的骨量丢失,不同研究似乎结论并不一致。此外,降钙素还可用于OVCF后的镇痛治疗。不良反应主要包括鼻黏膜刺激、鼻出血以及过敏反应等。鉴于既往分析提示,长期使用鲑鱼降钙素有增加恶性肿瘤风险的可能,目前推荐鲑鱼降钙素连续使用时间不超过3个月。 (5) 甲状旁腺素类似物:特立帕肽用于高骨折风险的绝经后骨质疏松症的治疗。经过平均18个月的治疗,可降低既往有椎体骨折的绝经后妇女椎体骨折风险65%、非椎体骨折风险53%,但尚无降低髋部骨折风险的临床证据。 特立帕肽不良反应包括恶心、眩晕、头痛等。在Paget病、有骨骼疾病放射治疗史、肿瘤骨转移及高钙血症的患者禁用;肌酐清除率<35 mL/min者禁用,此外也禁用于<18岁和骨骺未闭合的青少年。治疗时间不超过24个月。 (6) 活性维生素D或维生素D衍生物:包括1, 25双羟D3(骨化三醇)和1α羟基D3(α-骨化醇),但其在降低骨折风险方面的结论并不一致。活性维生素D或维生素D衍生物更适合老年人肾功能不全及1α羟化酶缺乏的患者,但不推荐作为日常补充。此外,治疗骨质疏松症时应定期监测血钙和尿钙水平。 4.药物治疗相关问题: (1) 用药时机:OVCF发生前,已经使用抗骨质疏松药物患者,可以继续使用;既往未使用抗骨质疏松药物者,应在骨折妥善处理、全身状况稳定时,根据病情尽早使用抗骨质疏松药物治疗。 (2) 治疗疗程:抗骨质疏松治疗药物需要长期、规范使用,治疗过程中规律随访,定期进行相关检查和风险评估。目前普遍推荐口服双膦酸盐治疗5年,静脉双膦酸盐治疗3年后,可以重新评估患者状况,决定继续用药或进入药物假期。药物假期中,也需要定期评估患者病情,决定是否重新启动治疗。应用甲状旁腺素类药物的患者,应用时间不超过24个月。除双膦酸盐以外的抗骨质疏松药物一旦停药,其治疗效果将消退,因此需要序贯其他治疗,否则会出现骨量流失、骨质量下降等治疗效果消退的情况。 (3) 对骨折愈合和内植物的影响:骨质疏松性骨折后,应重视积极抗骨质疏松药物治疗,常规剂量规范抗骨质疏松治疗不会影响骨折愈合,但需要早期识别容易发生骨折延迟愈合或不愈合的患者,以便及时进行随访和干预。研究显示双膦酸盐会使骨痂增大、矿化增加,但骨骼强度及机械力学特性不会受到影响,常规剂量的双膦酸盐不会导致骨折延迟愈合。骨质疏松性骨折内固定手术后,应用双膦酸盐可抑制骨量进一步丢失,提高内固定物稳定性,降低内固定移位发生率;特立帕肽可促进骨痂形成、提高骨痂矿化程度,改善骨骼生物力学特性。 (4) 联合治疗与序贯治疗:钙剂和维生素D作为骨质疏松症的健康补充剂,需要与抗骨质疏松药物联合使用。通常不建议同时应用相同作用机制的药物进行抗骨质疏松治疗。由于同时应用抑制骨吸收和促进骨形成类药物缺少对骨折疗效的证据,考虑到成本和获益,不建议这两类药物联合使用。此外,可根据患者病情选择不同机制抗骨质疏松药物序贯使用,有研究提示应用促骨形成药物后序贯使用抑制骨吸收药物,可以预防停药之后BMD下降以及骨折风险的升高。 治疗效果评价与随访监测 对于OVCF的治疗效果评价与随访监测包括对骨折的治疗以及骨质疏松症的治疗两方面。 对骨折治疗效果的评价 PVA术后监测包括基本生命体征及神经功能评估。PVA术后疼痛通常是轻度的,可采用非阿片类药物(如非甾体类解热镇痛药)镇痛,个别患者如出现中重度疼痛,可给予弱阿片(如可待因或曲马多)至强阿片类镇痛药(如吗啡)。术后复查常规行X线检查,仅在术后即刻或远期出现新发疼痛或疼痛持续时才考虑行MRI检查。如果患者术后疼痛加重,生命体征不稳或神经功能减退,则应进一步检查以明确是否有神经根或脊髓损伤或受压。 PVA术后少数患者会发热,2~3 d后体温降至正常,一般予非甾体类解热镇痛药等对症治疗,不需常规预防性使用抗生素;若全身状况差或有免疫抑制,具有较高感染风险时,应预防性使用抗生素。 骨水泥渗漏是PVA的常见并发症,多见于终板或椎间盘、椎旁、硬膜外、椎体前部。大多数渗漏无临床症状或症状轻微,予非甾体类解热镇痛药等对症处理即可;如发生脊髓压迫甚至出现截瘫,需行减压手术。其他并发症包括感染,肋骨、椎体后部、椎弓根骨折,邻近节段骨折,过敏,穿刺区出血或血管损伤,永久性神经损伤,血胸,气胸,死亡等。术后应积极行康复治疗,尽量避免大幅度腰部转体动作和弯腰动作,避免久坐久站,有益于骨折术后远期疗效。 对骨质疏松症治疗效果的评价 建议主要通过对BMD、BTM以及新发骨折评估骨质疏松症的治疗效果。 1.BMD:是目前广泛应用的疗效监测与评估指标,抗骨质疏松药物治疗后,BMD稳定或上升,治疗期间无骨折发生,提示药物治疗有效。如BMD明显下降,则应寻找骨量丢失的原因,并进一步调整治疗方案。开始抗骨质疏松药物治疗后,建议1~2年检测一次BMD,建议在同一家机构的同一台设备上进行检测。 2.BTM:如P1NP和S-CTX能够快速反映药物疗效,在药物治疗3~6个月即可发生明显变化,通过判断改变是否超过最小有意义变化值,不仅可用于药物疗效判定,同时也可反映治疗的依从性。可以考虑在应用促骨形成药物后3个月,抗骨吸收药物后3~6个月进行检测。如果抗骨吸收治疗中观察到BTM显著降低,表明与骨折发生率降低相关;在促骨形成治疗中BTM显著增加,表明治疗反应良好。 3.新发骨折:降低新发骨折风险通常需要较长时间的规律治疗才能达到效果,因此抗骨质疏松治疗过程中一次新发骨折不代表治疗失败,但提示患者具有高骨折风险。应每年测量身高,当身高降低超过2 cm时,应进行腰椎影像检查,以确定是否有新发椎体骨折。如治疗期间出现多次骨折,则应寻找原因并调整治疗方案。 康复治疗 OVCF患者的康复治疗要考虑到患者骨质量差和骨折愈合缓慢的特点,可根据患者情况采取多种康复措施,包括个性化的康复辅具、疼痛管理、物理疗法和康复训练等。 在不影响骨折制动和骨折愈合的前提下,应指导患者尽早开始康复训练,恢复关节功能,减少肌肉萎缩,增强肌肉力量,缩短卧床时间,减少并发症的发生。微创手术后12 h,患者即可尝试坐起及站立,应采用主动运动与被动运动相结合,以主动运动为主的运动方式。腰背部肌肉力量训练和平衡训练有助于加速患者恢复。 疾病管理模式探索 骨质疏松症及OVCF是多学科、交叉领域的常见疾病,而打破骨质疏松症与脆性骨折之间的循环机制更迫切需要多方共同努力,探索合理的疾病管理模式。2012年,IOF发起了以“Capture the Fracture”(攻克骨折)为主题的行动,提出“使初次骨折成为最后一次骨折”的工作目标,并倡导多部门合作、以骨折联络员为基础的骨折联络服务(fracture liaison service, FLS)体系,主要包括识别脆性骨折患者、个体化评价与处理、随访和长期治疗和患者随访、评估治疗与结局四个方面。 FLS体系在全球范围内的逐渐推广与实践,显著提高了脆性骨折患者骨质疏松症的诊断率、抗骨质疏松药物使用率、管理率和依从性,达到了降低再发骨折、改善生活质量、减少患者经济负担的目的。 中华医学会骨质疏松和骨矿盐疾病分会倡导国内骨质疏松领域的临床工作者积极筛查椎体骨折高危患者,开展骨折联络服务,探索适合中国国情的骨质疏松疾病管理模式,如内外科转诊制度的规范化建设、多学科联合治疗中心的建设等,旨在提高骨质疏松症的诊疗率,降低脆性骨折所致病死率。希望通过这一模式的探索与实践,提高患者、医务人员、医疗机构、相关学术组织、政策制定者和政府等各方对骨质疏松症的认识,提高疾病诊疗水平,以减少骨折的再发生、降低骨折后患者致残率及病死率和由此造成的巨额医疗费用。
发生骨质疏松性椎体骨折后,椎体压缩,将导致患者身高变矮、脊柱后凸、侧弯、畸形和驼背等,进而造成患者背痛,心、肺功能显著下降和胃肠功能紊乱等;骨质疏松性椎体骨折老年患者骨折后骨痂形成过程减缓,易出现骨折延迟愈合或不愈合;骨折后卧床制动则可引起骨量快速丢失,加重骨质疏松症,并引起各种并发症,致残率及致死率较高。2015年一项中国人群研究显示,骨质疏松性椎体骨折患者1年后的病死率为3.1%,明显高于普通人群(1.6%),有23.8%的患者生活自理能力受损,且受累椎体越多,死亡风险越高。骨质疏松性椎体骨折后再发骨折的风险也明显升高,国内研究显示初次椎体骨折后2~3年内,再发骨折率高达10.3%;国外研究结果显示,与未发生过骨折的患者相比,椎体骨折后患者再次发生椎体骨折的风险增加4.4倍,其他部位如髋部骨折风险可升高2.3倍。
因此,必须采取有效的筛查手段和干预措施,以减少OVCF对加速老龄化社会人口健康及社会经济的影响。