双膦酸盐治疗成骨不全症达药物假期时患者临床特点
来源:csobmr 发布日期:2018-05-10 16:04:16浏览:3272次
作者:宋玉文 吕芳 李路娇 徐晓杰 王鸥 姜艳 夏维波 邢小平 李梅
单位:中国医学科学院 北京协和医学院 北京协和医院内分泌科 国家卫生健康委员会内分泌重点实验室
摘要:目的 研究双膦酸盐(bisphosphonates,BPs)治疗成骨不全症(osteogenesis imperfecta,OI)骨密度(bone mineral density,BMD)达正常而进入药物假期患者的临床特点。方法 回顾性分析2004年1月至2015年12月在北京协和医院治疗的OI患者,纳入BPs治疗后BMD达正常而停药的35例OI儿童为停药组,以年龄、性别、疗程匹配且因BMD仍低而继续治疗的35例OI儿童为对照组,应用双能X线吸收检测法测量BMD,并测定血清碱性磷酸酶(alkaline phosphatase,ALP)和Ⅰ型胶原羧基端交联肽(β-cross linked C-telopeptide of type 1 collagen,β-CTX)的浓度,对比分析两组基线、治疗期间及停药时BMD、骨转换生化指标的差异。结果 停药组平均治疗4年BMD达正常而停药,该组基线腰椎、股骨颈、全髋BMD明显高于对照组[(543±229)mg/cm2vs.(419±182)mg/cm2、(513±241)mg/cm2vs.(300±231)mg/cm2、(573±216)mg/cm2vs.(328±226)mg/cm2],停药组治疗前年骨折次数低于对照组[(1.3±2.6)次vs.(2.1±3.5)次,P < 0.05];治疗4年时,两组各部位BMD均较基线增加,但BMD变化率无明显差异,新发年骨折次数及血ALP、β-CTX降低率差异均无统计学意义(均P > 0.05);在停药时,停药组腰椎、股骨颈、全髋BMD仍明显高于对照组[(1 065±129)mg/cm2vs.(803±170)mg/cm2、(944±92)mg/cm2vs.(674±140)mg/cm2、(941±92)mg/cm2vs.(687±140)mg/cm2,均P < 0.01]。结论 BPs能够增加不同病情OI患者的BMD,降低骨折率和骨转换生化指标。病情较轻的OI患者接受平均4年BPs治疗后有望BMD达正常而停药,而病情较重的OI患者则需BPs治疗更长时间。
关键词:成骨不全症;双膦酸盐;药物假期
成骨不全症(osteogenesis imperfecta, OI)是以骨脆性增加、反复骨折、骨骼畸形为特征的单基因遗传病,可有蓝巩膜、听力障碍、牙本质发育不全、韧带松弛等骨外表现。OI患者临床表型轻重不等,基于基因型和临床表型,可分为5型:Ⅰ型为轻型,Ⅱ型为围生期致死型,Ⅲ型为存活患者中最严重的类型,Ⅳ型严重度介于Ⅰ型和Ⅲ型之间,Ⅴ型具有前臂骨间膜钙化、桡骨小头脱位等特殊表现。OI由于引发反复骨折、进行性骨畸形,严重影响患者生活质量,也给家庭和社会带来沉重经济负担,然而,目前尚无针对其病因的有效治疗方法。
双膦酸盐(bisphosphonates, BPs)类药物目前广泛应用于治疗儿童及成人OI,通过与骨骼羟基磷灰石的高亲和力,能特异性结合于骨矿盐表面,影响破骨细胞微骨架和皱褶缘的形成,抑制其释放酸性物质及酶类,减少骨吸收、增加骨密度(bone mineral density,BMD)。然而,BPs对不同临床表型的OI患者,药物疗程是否存在差异,尚不清楚。为此,本研究对BPs治疗后BMD达正常而进入药物假期的OI患者,以及治疗时间相同、年龄性别匹配、因BMD仍低而继续治疗的OI患者,进行回顾性对比分析,比较两组基线及进入药物假期时的临床特点、药物疗效的差异,以探讨不同病情OI患者接受BPs治疗的适宜疗程。
对象与方法
对象
从2004年1月至2015年12月于北京协和医院内分泌科门诊确诊并规律接受口服或静脉BPs治疗的OI患者中,选取治疗后BMD达同性别正常成人范围而进入药物假期的35例患儿归入停药组,平均年龄(9.1±4.6)岁;以同期年龄、性别、药物疗程匹配,BMD仍低,需要继续接受BPs治疗的35例OI患者为对照组,平均年龄(9.1±4.5)岁。入组标准:年龄<18岁;符合OI诊断标准。
OI诊断标准:(1)从小发病,≥1次非暴力性骨折;(2)BMD Z评分<-2.0;(3)骨骼X线片示长骨纤细、皮质菲薄;(4)伴或不伴蓝巩膜、听力异常、关节韧带松弛、牙本质异常;(5)伴或不伴头颅缝间骨、骨骼畸形。OI分型标准:主要参照2015年国际骨骼发育异常协会(International Skeletal Dysplasia Society)制定的OI分型标准,结合患者病情严重程度分为Ⅰ、Ⅲ、Ⅳ型。停药标准:腰椎及全髋BMD达到正常成人BMD,即腰椎:男性1.002 g/cm2,女性0.956 g/cm2;全髋:男性0.966 g/cm2,女性0.874 g/cm2。
方法
记录患者治疗0、1、2、3、4年及停药时骨转换生化指标、BMD,评估治疗前骨折率及治疗期间新发骨折率,记录患者年龄、身高、体质量,计算体质量指数(body mass index, BMI)。
药物治疗:唑来膦酸(密固达,诺华制药公司,瑞士),每年1次,每次输注5 mg,静脉输注至少15 min;阿仑膦酸钠(福美加,默沙东制药公司,美国),每周服用1次,每次70 mg,空腹用至少250 mL白水送服,服药后30 min避免平卧及进食。停药组有13、8、14例分别接受唑来膦酸、阿仑膦酸钠或两药序贯治疗;对照组有11、11、13例分别接受唑来膦酸、阿仑膦酸钠或两药序贯治疗。
骨生化指标检测:采用自动分析仪检测血钙、血磷、骨形成指标碱性磷酸酶(alkaline phosph-atase,ALP)浓度;采用化学发光法测定血清25羟维生素D(25 hydroxy vitamin D,25OHD)及骨吸收指标Ⅰ型胶原羧基端交联肽(β-cross linked C-telopeptide of type 1 collagen,β-CTX)浓度。
BMD测量:采用双能X线吸收检测法(dual energy X-ray absorptiometry,DXA)(Lunar, GE Healthcare, 美国)测量腰椎(lumbar 2-4, L2-4)、股骨颈(femoral neck, FN)、全髋(total hip, TH)BMD。
统计学方法
根据中国和亚洲正常儿童BMD值计算年龄、性别校正后Z值。因缺乏亚洲儿童及青少年正常全髋BMD参考值,本文未计算全髋BMD Z值。采用SPSS 20.0软件进行统计分析。计量资料以均数±标准差(x±s)表示,计数资料以百分率(%)表示,每组治疗前后数据,采用配对样本t检验或Wilcoxon检验;两组间比较,采用独立样本t检验或χ2检验。以P<0.05为差异有统计学意义。
结 果
两组基线资料比较
根据患者病情轻重,停药组Ⅰ型、Ⅲ型、Ⅳ型患者分别为33(94.3%)、0(0%)、2(5.7%)例,对照组分别为11(31.4%)、7(20.0%)、17(48.6%)例,两组构成比差异有统计学意义(P均<0.05),对照组病情较重的Ⅲ型、Ⅳ型患者所占比例更大;停药组临床表现较轻,其骨骼畸形、牙本质发育不良、头颅缝间骨和椎体压缩性骨折的发生率显著低于对照组;停药组身高Z值(-0.8±1.7)显著高于对照组(-3.3±3.0)(P<0.01)。停药组治疗前年骨折次数(1.3±2.6)少于对照组(2.1±3.5)(P<0.05)(表1)。

停药组L2-4、FN、TH BMD高于对照组,L2-4、FN BMD Z值(-1.5±2.6、-2.5±2.4)显著高于对照组(-2.9±2.1、-5.2±2.9);两组患者血清ALP、β-CTX、25OHD水平差异无统计学意义(表2)。

两组BPs治疗效果比较
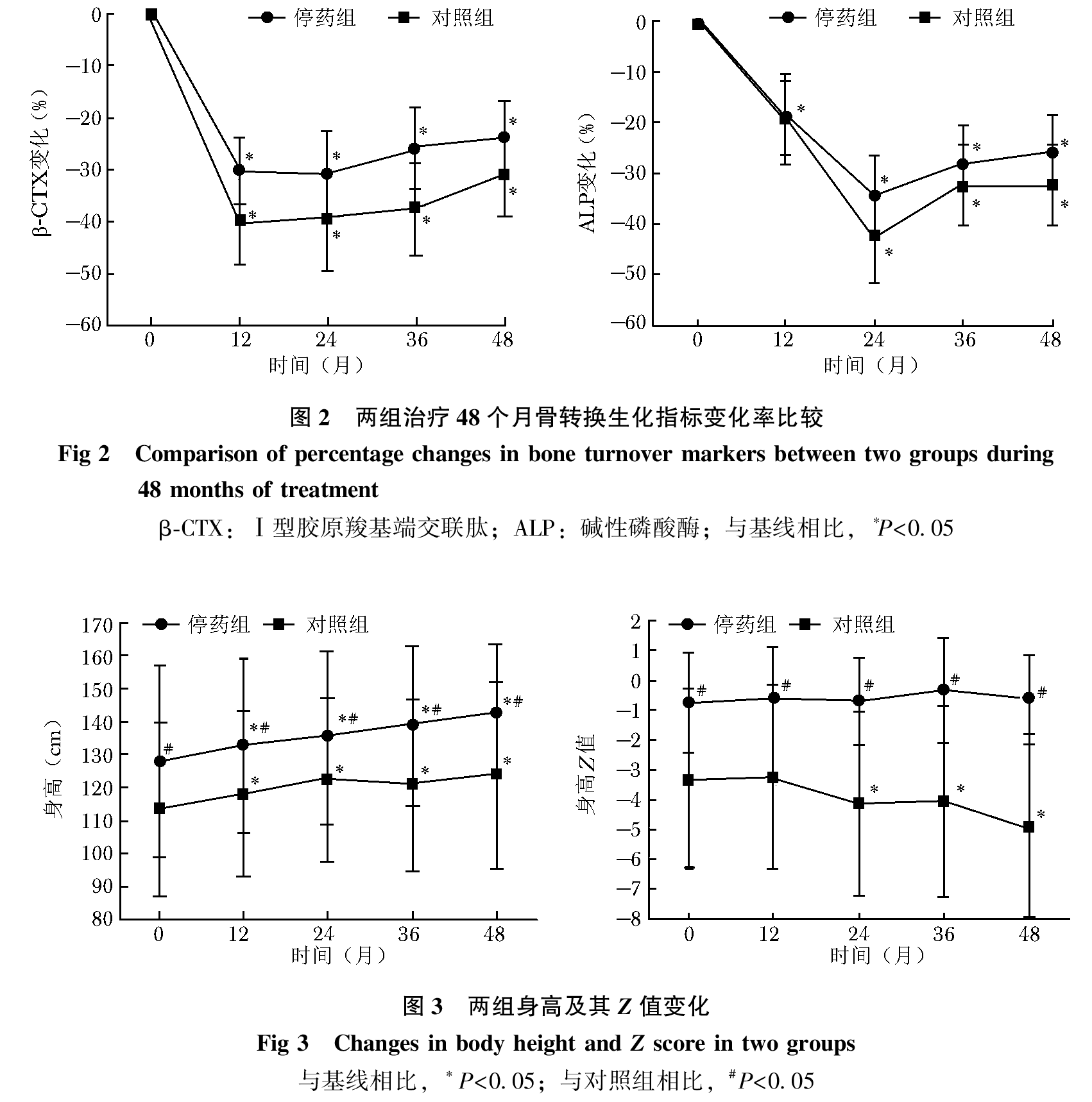
经过平均4年双膦酸盐治疗,停药组BMD达正常水平,因而进入药物假期。4年治疗期间,两组各部位BMD较基线均明显升高,停药组及对照组腰椎BMD分别增加138.0%及161.4%,股骨颈BMD分别增加126.7%和113.5%,全髋BMD分别增加79.1%及87.1%,除治疗2年时对照组全髋BMD变化率高于停药组(P=0.010),BMD升高率组间差异无统计学意义(P均>0.05);两组L2-4、FN BMD Z值也逐年上升,两组间差异无统计学意义(P均>0.05)(图1);两组血清β-CTX及ALP水平较基线明显下降,组间下降率差异无统计学意义(P均>0.05,图 2);停药组身高逐年增加,但身高Z值与基线相比无增加,对照组治疗期间身高有所增加,而身高Z值下降(图3)。
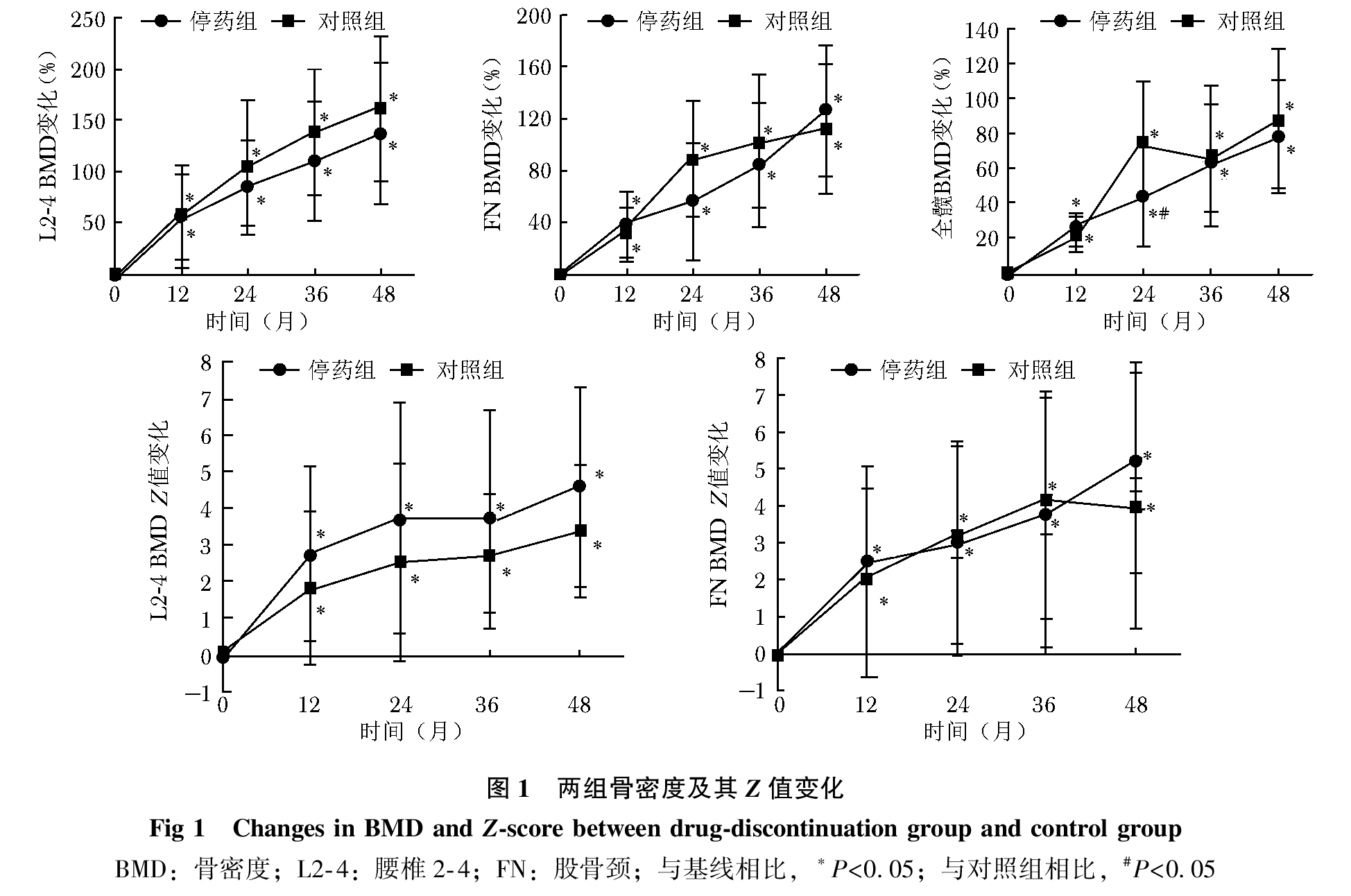
停药组进入药物假期时,两组BMD及骨折次数比较
停药组进入药物假期时,L2-4、FN、TH BMD分别为(1 065±129)mg/cm2、(944±92)mg/cm2、(941±92)mg/cm2,明显高于对照组(803±170)mg/cm2、(674±140)mg/cm2、(687±140)mg/cm2(P均<0.01);L2-4、FN BMD Z值(2.5±1.8、1.2±1.7)高于对照组(0.2±1.7、-1.4±2.0)(P均<0.01)(表 3)。另外,两组患者在治疗期间新发年骨折次数、β-CTX及ALP降低率差异均无统计学意义(P均>0.05)。

讨 论
本研究显示BPs治疗能够有效增加OI患者BMD,减少新发骨折,降低骨转换率。停药组平均治疗4年BMD达正常而进入药物假期,该组患者临床表型相对较轻,Ⅰ型占比较高;对照组患者临床表型较重,主要为Ⅲ/Ⅳ型,患者需要接受更长期的BPs治疗。
双膦酸盐类药物是目前治疗OI的主要药物。在大样本OI患儿中,BPs可降低骨转换生化指标、增加BMD、改善骨微结构。然而,BPs治疗OI的长期有效性和安全性尚不清楚。目前小样本研究报道帕米膦酸钠治疗OI最长时间为13.5年,其中11.5年为标准剂量,此后2年为低剂量维持,治疗期间患者全髋或腰椎BMD Z值维持于-0.5以上,骨转换持续抑制,骨折率明显降低,提示帕米膦酸钠对OI患儿长期治疗安全有效。有研究对79例OI患儿予帕米膦酸钠长期治疗,平均疗程10.4年,治疗前4年患者BMD显著增加,骨折率持续下降;治疗结束时,BMD仍然明显高于基线,骨折率处于较低水平。本组曾采用阿仑膦酸钠治疗相对大样本的OI患儿3年,结果发现,阿仑膦酸钠治疗使患者BMD增加、骨折率明显降低,且安全性好。但是,随着对OI自然病程的认识,对BPs药理作用的深入研究,以及长期BPs治疗可能引起非典型骨折及下颌骨坏死等不良反应的报道,OI患者长期接受BPs治疗的利弊值得探讨。本研究纳入70例OI儿童,BPs平均治疗时间长达4年(1~8年),患者腰椎、股骨颈及全髋BMD均显著增加,骨折率明显降低,未见非典型骨折等不良反应,提示阿仑膦酸钠、唑来膦酸或二者序贯治疗4年对OI患者安全有效。
关于BPs治疗OI患者的停药时机,存在争议。Trejo等建议,对于OI儿童,给予静脉输注唑来膦酸每6个月0.05 mg/kg治疗,当患者达到终身高时,停用BPs;若身高仍在增长,当腰椎BMD Z值增加至>-2.0时,唑来膦酸减量至每6个月0.025 mg/kg,当腰椎BMD Z值增至>0时,则给予唑来膦酸每年0.025 mg/kg低剂量维持治疗,直至患者生长停止。但也有研究者认为,BPs治疗第1年BMD增加最明显,最佳疗程为2~4年,此后BMD达平台期,可进入药物假期。本研究综合考虑患者BMD获益,在BMD达同性别正常成人BMD值后予以停药。本研究停药组94.3%的患者为Ⅰ型,即轻型OI,而对照组绝大多数为病情较重的Ⅲ型与Ⅳ型OI,停药组基线BMD较高,骨折率低,骨骼畸形、牙本质发育不全也明显低于对照组,表明临床表型较轻的OI患者有望于平均治疗4年BMD正常,可考虑停药观察,而病情较重的OI患者则需要接受更长时间的治疗。
由此可见,双膦酸盐类药物可有效降低不同病情OI患者的新发骨折率、抑制骨转换率、增加BMD及其Z值。对于病情较轻的OI患者,双膦酸盐类药物平均治疗4年,BMD有望达正常水平,可考虑停药观察,而对于病情较重的OI患者,可能需要双膦酸盐类药物治疗更长的时间。本研究为成骨不全症患者接受个体化的双膦酸盐类药物治疗,提供了有益的临床研究基础。