氯离子通道蛋白7相关骨硬化症
来源:CSOBMR 发布日期:2017-12-21 12:03:02浏览:3344次
作者:程健豪 汪纯 章振林
单位:上海市第六人民医院骨质疏松科
摘要:氯离子通道蛋白7(chloride channel 7,CLCN7)是一种特异性位于破骨细胞上的氯离子通道,CLCN7基因缺陷会导致一类以破骨细胞吸收功能障碍为主要特点的骨硬化症。根据临床表现可将CLCN7相关的骨硬化症分为常染色体隐性遗传恶性骨硬化症(autosomal recessive osteopetrosis,ARO)、常染色体隐性遗传中间型骨硬化症(intermediate autosomal osteopetrosis,IAO)和常染色体显性遗传良性骨硬化症(autosomal dominate osteopetrosis type Ⅱ,ADOⅡ)。本文对CLCN7基因功能缺陷所导致的骨硬化症的诊断及治疗做一综述。
关键词:氯离子第7通道蛋白;突变;骨硬化症
电压门控氯离子通道蛋白(chloride channel,CLCN)家族主要由9种不同的通道蛋白构成,其中CLCN-1、CLCN-2和2种CLCN-k作为主要氯离子通道位于质膜上,而CLCN-3、CLCN-4、CLCN-5、CLCN-6和CLCN-7则被认为广泛地表达于各类细胞和细胞器上。这些通道蛋白同时也是质子泵,将氯离子转运到细胞内的同时也反向转运氢离子到细胞外。在这些通道蛋白中以CLCN7最受瞩目,目前的研究已经证实,CLCN7基因敲除的小鼠罹患严重的骨硬化症和退行性神经疾病。本综述对CLCN7的最新研究进展进行总结。
CLCN7基因及编码蛋白
CLCN7基因定位于人类染色体16p13,是由相对分子质量位26 000的基因组DNA编码而成,有25个外显子。小鼠CLCN7基因编码803个氨基酸。编码人类的CLCN7基因结构与小鼠的基因结构类似度高达96.1%。目前的研究发现CLCN7结构高度保守,在哺乳动物里没有发现与之结构不同的同源蛋白。
氯离子通道蛋白是由两个同源单体以反向对称结构组成的同源二聚体,每一个同源单体包含18个膜内的α螺旋体,这18个膜内α螺旋体不具有跨膜功能。此外还有4个的Cl-结合位点,2个CBS结构域构成的跨膜结构(图1)。
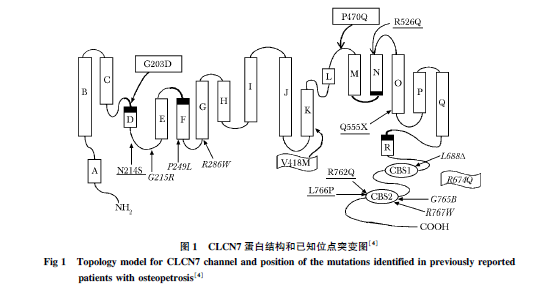
实验已经证实CLCN7基因在小鼠各细胞内广泛表达。例如肾脏的近端小管、小脑的蒲肯野纤维内、大脑的延髓内、以及肝脏细胞和睾丸内。而CLCN7的亚细胞定位主要位于细胞的溶酶体以及破骨细胞褶皱的表面。
CLCN7基因的表达对于破骨细胞具有极其重要的作用。破骨细胞是一种多核细胞,它通过骨吸收维持体内的稳态并重塑骨组织。为了发挥破骨作用,破骨细胞首先需要黏附在骨基质上,然后在骨基质和褶皱的破骨细胞表面产生一个骨陷窝。破骨细胞持续向骨陷窝内分泌H+离子,使得整个骨陷窝的pH值维持在4左右,从而可以溶解骨基质并完成骨代谢的各种活动。一般认为V型质子泵持续向外泵出氢离子,而CLCN7作为H+/ Cl-反向转运体向骨陷窝内泵出H+的同时反向吸收Cl-。虽然CLCN7不直接参与溶酶体酸化的过程,但是它可能为构建溶酶体电荷平衡起重要作用。因此失去CLCN7功能的溶酶体无法发挥其作用(图2)。
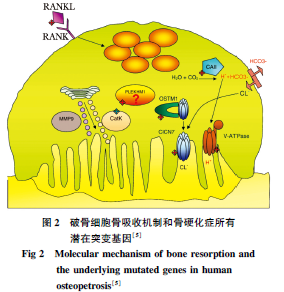
CLCN7基因敲除的小鼠会出现严重的骨硬化症和溶酶体蓄积症的表型。尽管CLCN7基因敲除小鼠破骨细胞数量正常,但是由于溶酶体无法发挥正常作用,因此破骨功能无法正常实行。除了骨硬化症之外,小鼠还出现了非常严重的视网膜退化。一些研究认为这是由严重的骨硬化压迫视神经孔所导致的,但是也有研究指出这是由CLCN7通道功能缺陷所导致的。实验还观察到CLCN7基因敲除小鼠有类似大脑脂褐素沉积症的表现,而这在传统的质子泵亚基突变小鼠中从未出现过。之前有研究认为是溶酶体蓄积症的表现。
CLCN7基因突变导致骨硬化症
CLCN7基因突变所导致的骨硬化症疾病谱范围非常广,包括常染色隐性遗传婴幼儿恶性骨硬化症(autosomal recessive osteopetrosis,ARO)、常染色隐性遗传的中间型骨硬化症(intermediate autosomal osteopetrosis,IAO)和常染色体显性遗传2型骨硬化症(autosomal dominant osteopetrosis type Ⅱ,ADOⅡ,又称为Albers-Schnberg disease)(表1)。

ARO一般于婴儿期起病,由于CLCN7氯离子通道失活,导致破骨细胞功能障碍,全身的骨骼过度矿化而对全身各个器官产生严重影响。由于骨的微观结构发生变化,骨骼变得犹如粉笔一般脆弱,在轻微外力下即可发生长骨的骨折,此外长骨的生长需要破骨细胞正常的活动,CLCN7的缺如致使破骨细胞无法正常发挥功能,因此ARO的患者一般会生长迟滞。更为严重的是,患者会伴有颅骨硬化(可伴有或不伴有后鼻孔狭窄及脑积水),大量增生的骨组织封闭了颅神经孔,使颅神经受到压迫,出现失明、面瘫和听力障碍等。ARO患儿骨髓腔消失导致骨髓腔挤压综合征。由于骨骼的过度矿化,髓腔的体积严重减少从而累及造血功能,最终发生严重的贫血、继发性肝脾肿大和髓腔外造血。同时患者有全血细胞减少的表现,血小板数量低下。一旦发生神经系统出血则可能致命。同时患者的粒细胞数目稀少,因此会有免疫功能低下的表现。此外患者也可伴有出牙延迟,牙釉质发育不良,牙釉质和牙质的矿化障碍及牙体良性肿瘤。由于破骨细胞功能障碍,患者也可表现为低钙血症并伴有强直性抽搐以及继发性甲状旁腺功能亢进症。恶性骨硬化症在不加治疗的情况下,患者的预期寿命只有10年。
ADOⅡ型一般起病于青春期。其主要并发症是骨折,考虑为骨骼脆性增大所致。文献报道人均骨折的次数约为3次,有的甚至有10余次的骨折。最常受累的骨骼为股骨和椎骨的后椎弓根。同时还可伴有脊柱侧弯、骨关节炎和骨髓炎。骨关节炎的受累部位多为髋关节,由关节下软骨的硬化导致。而骨髓炎最常见的是下颌骨的骨髓炎,为细菌感染所致。颅神经压迫症状则非常罕见,一般认为视神经和听神经的受压损伤率小于5%。ADOⅡ型患者的特征性影像学包括脊椎上下终板骨密度明显增高,出现“夹心饼干样”椎体征(sandwich vertebrae)、髂骨骨密度不均匀增高,可见“骨中骨”现象(bone within bone appearance)、股骨远端骨密度弥漫性增高(erlenmeyer-shaped femoral metaphysis)呈“酒瓶征”或“锥形烧瓶征”、颅骨骨密度中等程度的增高和长骨硬化的横带(transverse band of osteosclerosis in longbones)(图3)。ADOⅡ患者的预期寿命一般与正常人无明显差异。
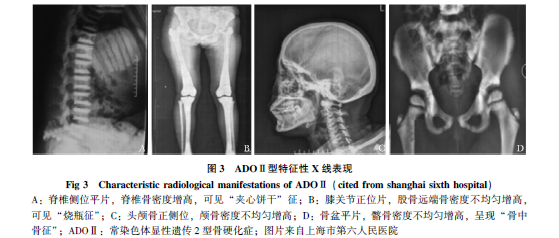
IAO一般起病于儿童时期。临床表现与恶性骨硬化症状相似,但是恶性程度却远不及恶性骨硬化症。可发生轻微外力下的骨折。患者的血液学表现可能仅仅为中等程度的贫血。此外,尽管神经系统很少累及,但是继发于视神经损伤的视力损害仍然可以出现。一般患者都是因为偶发的X线检查发现的,影像学表现基本等同于恶性骨硬化症。IAO患者的预期寿命一般与正常人的没有差别。
CLCN7新发突变以及突变表型和基因型的关系
近几年来全球报道的所有CLCN7基因突变导致骨硬化症的突变位点和疾病类型见表2。
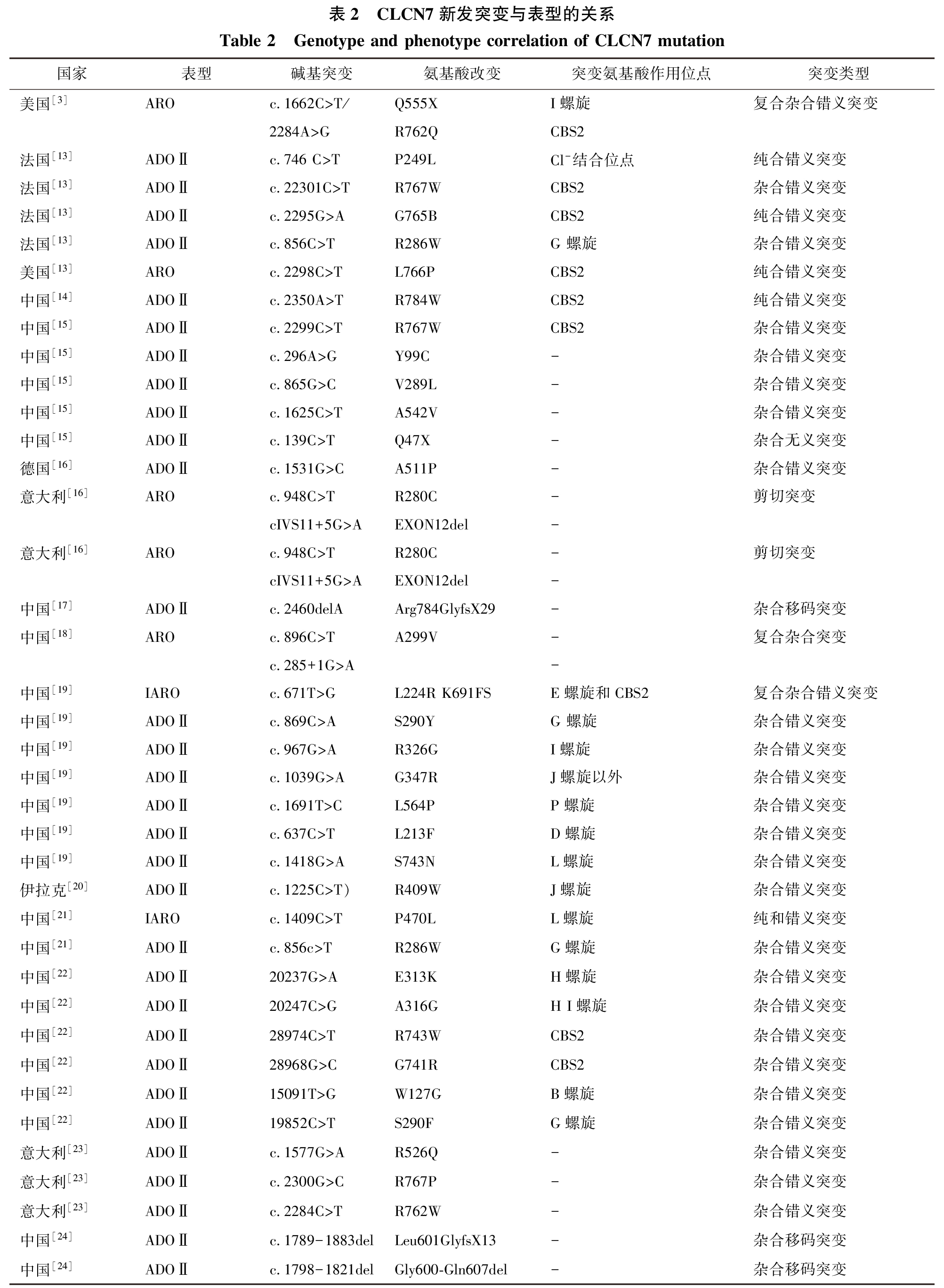
分析表2可发现:首先,CLCN7基因突变所引起的骨硬化症具有异质性,可以从具有强烈恶性倾向的ARO,到几乎没有任何症状的ADOⅡ;疾病特征并非特异,鉴别诊断较为困难。第二,导致ADOⅡ型骨硬化症的突变多位于膜内α螺旋体上,或CBS1结构域内(图1)的杂合错义突变。有研究推测,在Cl-结合位点可能存在一个正离子通路,此通路与结合该通路位点的经突变形成的残基仅干扰Cl-离子的渗透。不直接参与离子反向转运的过程,故氯离子仍然可以完成转运过程。所以患者表现的症状较为轻。而ARO型骨硬化症大多是由于纯和错义突变或者剪切突变所导致的,这些突变导致大多氨基酸序列排列错位,Cl-通道功能几乎完全受损,严重影响破骨细胞的功能,故患者表现的症状较为严重。第三,另根据Palagano等最新研究结果显示,某些同义突变也可以影响剪切,故可以导致恶性骨硬化症的发生。目前就某些蛋白亚基的功能研究仍待深入进行。
CLCN7基因相关骨硬化症的治疗
因为CLCN7基因突变所致的骨硬化症有很强的异质性,ARO和ADOⅡ的治疗策略是完全不同的,而IARO则介于二者之间。因此骨硬化症的个体化治疗显得尤为重要。
ADOⅡ型骨硬化症
患者往往并发骨关节炎而且由于骨的脆性非常大容易导致骨折,甚至常常会有骨折的延迟愈合和不愈合的现象产生。同时感染和下颌骨髓炎也是常见的(>50%)并发症,因此应该强调额面部及口腔部位的常规检查。若骨折位于关节,则全关节置换是非常必要的。由于Ⅱ型骨硬化症的预期寿命往往与正常人类似,因此目前仅给予一般的对症治疗。
ARO型骨硬化症
造血干细胞移植:由于破骨细胞来源于造血干细胞,(hematopoietic stem cell transplantation,HSCT)目前是治愈ARO的唯一手段。大部分的症状(如骨硬化、骨髓衰竭和骨髓外造血等)都可以经HSCT治疗而得到逆转。然而继发于ARO的症状,如神经的压迫是不能被逆转的。因此一旦明确诊断为ARO,应该尽早将患儿收入大型儿科医学中心,多学科合作进行病情和个体预后状况的评估。同时需要注意的是CLCN7基因突变所导致神经型ARO是无法逆转的,因此对于这类患者只能提供支持治疗。
2013年,Sobacchi等对欧洲骨髓移植中心进行回顾性调查研究,一共收集了自1980年起来自欧洲、中东和北美的ARO病例125例。自体基因造血干细胞移植的5年存活率为88%,异体基因造血干细胞移植的5年存活率为80%,半相合造血干细胞移植的5年存活率为60%。HSCT后的并发症种类繁多,尤其是异体造血干细胞移植术后,其并发症包括:排异反应、造血重建延迟和静脉闭塞性疾病。由此可见,虽然HSCT对ARO的治疗有很好的疗效,但是基于以上的局限性以及诸多的并发症,迫切需要开发新的药物来治疗骨硬化症。
骨髓功能衰竭:新诊断的患儿需要及时进行红细胞及血小板的输入治疗。而粒细胞缺乏和低免疫球蛋白血症的患儿,给予抗生素和免疫球蛋白的预防性治疗是非常重要的。
保守性治疗:针对ARO,药物治疗方法目前包括限制性地使用钙剂、骨化三醇、固醇类激素、甲状旁腺激素。最早根据Blazar等的研究,针对1例恶性骨硬化的患者,连续4周给予24 μg/d的钙剂的冲击治疗,4周后患者血钙保持稳定,但骨髓穿刺显示,患者的骨髓相相对治疗前并没有产生变化。同时Glorieux等也有运用PTH以提高患者血钙的病例报道,针对1例恶性骨硬化并伴有低钙血症的患者,给予患者持续3周注射1.5单位/千克iPTH,3周后发现患者血钙提升至101 mg/L,尿羟脯胺酸也增加至6.5 mg/L。患者破骨细胞的数量增长了93%,骨吸收面积增长了136%。对于此种类型的患者,保持血钙稳定是一项既矛盾又非常重要的治疗措施,一方面一般生理剂量的维生素D和钙剂对佝偻病的患儿非常重要,另一方面限制维生素D和钙量又对造血干细胞移植后可能出现的高钙血症有重要意义,内科医师应该强调个体化治疗,探索出适合患者的最佳治疗方案。但以上治疗方法并不能彻底根治骨硬化症,目前仅被认为可以维持患者血钙平衡延缓疾病进展。除上述报道的药物之外,INF γ-1b也被提示对于各型骨硬化有治疗效果,Alam等同时给予ADOⅡ型骨硬化小鼠干扰素和盖三醇,经实验证实,INFγ-1b在任何剂量下都能显著改善骨硬化小鼠的表型,而高剂量骨化三醇组不仅不能缓解相关症状反而增加了骨量。因此作者对目前使用骨化三醇治疗骨硬化症提出质疑,并且希望推广INFγ-1b在骨硬化症患者中的应用。而对于ARO、INF-1b也有很好的疗效,在临床试验中,14例ARO患者给予每周3次按每1.5单位/千克注射干扰素。尽管破骨细胞数量并未增加,但是单个骨细胞吸收功能增强。骨髓穿刺提示,患者的骨矿化较治疗前有明显的增长。但此类药物具体治疗的机制,目前仍待深入探究。
口腔疾病:在正常的生理情况下,出牙需要破骨细胞发挥正常功能,在不进行造血干细胞移植(hematopoietic stem cell transplantation,HSCT)治疗的情况下,大多数患儿无法存活到二次出牙以后,而在接受HSCT的治疗后患儿的二次出牙一般是正常的。但是牙齿的形状、面积以及矿化障碍、出牙不全等异常现象依然存在。在某些严重的个案报道里,出牙不全、下颌关节强直及关节脓肿这些都需要特殊的外科手术治疗。另外此类病人还需要防治下颌骨骨髓炎。
新的治疗方法:由于分子生物学和基因工程的进步,细胞介导的基因治疗或许将成为治疗骨硬化症的关键性手段。由于HSCT的局限性,并不是所有的ARO患者都能找到相应的配体,但因为患者往往有代偿性的髓外造血,患者外周血中有大量的CD34+细胞。目前已经有动物实验证实,将携带正常基因的慢病毒转染这些CD34+细胞,就能表达具有正常功能的破骨细胞。Johansson等对15只OC/OC小鼠皮下注射了经过反转录病毒转染过的造血干细胞,结果8只小鼠的预期寿命延长,并且在组织学层面上证实了这些小鼠体内的破骨细胞具有正常功能。这为骨硬化症患者的治疗带来了一丝曙光。但是不能忽视的是,在基因治疗的临床实验中,经过这种病毒转染的造血干细胞治疗的患者白血病患病率激增。或许随着第三代慢病毒载体的开发,这个问题终将解决。
展望
近10年来,随着分子生物学的发展,骨硬化症在诊断、分子生物学分型以及治疗上都取得了突破性的进展。随着高通量和全外显子测序技术的突破式进展,在不远的未来可能会发现更多的CLCN7和其他基因的突变位点。但是CLCN7基因突变所导致的临床表型迥异以及氯离子通道蛋白的功能研究仍然有待进一步深入。笔者期待能从分子水平阐明骨硬化症的发病机制,并且通过此类研究开发出治疗骨质疏松以及骨肿瘤的药物。