长链非编码RNA-ANCR对小鼠血管平滑肌细胞成骨样分化的影响
来源:CSOBMR 发布日期:2017-08-24 12:02:56浏览:11651次
作者:
陈秀鹃1,2 孙琳2 张正军2 李懂2 宋敏2 王娜2 张波2 梁秋华2
单位:
1. 济宁医学院研究生处
2. 济宁医学院附属医院内分泌科
摘要:目的 观察长链非编码RNA-抗分化非编码RNA(anti-differentiation non-coding RNA,ANCR)对动脉钙化细胞模型的影响,探讨其可能的作用机制。方法 以10 mmol/L β-甘油磷酸钠(beta-glycerophosphate,β-GP)诱导小鼠血管平滑肌细胞(vascular smooth muscle cells,VSMCs)成骨样分化以建立动脉钙化细胞模型,构建ANCR过表达慢病毒载体并感染小鼠VSMCs,qPCR检测Runt相关转录因子2(Runt related transcription factor 2,Runx2),骨形成蛋白-2(bone morphology protein-2,BMP-2)和ANCR的表达,Western blot检测胞质蛋白Runx2、BMP-2及核内核转录因子-Kappa B(nuclear factor kappa B,NF-κB)p65的表达,茜素红染色观察矿化结节的形成。结果 (1)β-GP刺激后小鼠VSMCs中Runx2和BMP-2的表达显著升高,差异有统计学意义(P < 0.05),茜素红染色可见明显的矿化结节。(2)β-GP刺激后小鼠VSMCs中ANCR的表达显著降低,Runx2和BMP-2的mRNA表达显著增加,差异有统计学意义(P < 0.05)。(3)ANCR过表达慢病毒感染后与对照组相比,Runx2和BMP-2的mRNA水平和蛋白水平均显著下降,NF-κBp65的蛋白表达显著降低,钙化结节形成显著减少,差异有统计学意义(P < 0.05)。结论 ANCR能抑制Runx2和BMP-2的表达,且可能通过削弱NF-κB信号通路抑制β-GP诱导的小鼠VSMCs成骨样分化。
关键词:动脉钙化;血管平滑肌细胞;成骨样分化;长链非编码RNA;核转录因子-kappa B;
动脉钙化是普遍存在于冠心病、糖尿病、慢性肾脏疾病等疾病中的病理现象,其细胞学基础是血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的成骨样分化。研究表明,在动脉钙化的过程中,VSMCs分泌大量的骨相关蛋白如碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(osteocalcin,OCN)、Runt相关转录因子2(Runt related transcription factor 2,Runx2) 和骨形成蛋白-2(bone morphology protein-2,BMP-2) 等而具有成骨细胞的表型,其确切的机制尚不完全明确。动脉钙化是急性心肌梗死、脑梗死、截肢等发生的独立危险因素。因此,研究动脉钙化的治疗和干预措施具有重要意义。
长链非编码RNA(long non-coding RNA,IncRNA)是近年来发现的、长度超过200个碱基的RNA,该类RNA不编码蛋白,但能够在转录及转录后水平调节蛋白编码基因的表达。研究表明,IncRNA在生长发育、细胞定向分化、亚细胞结构分布、进化选择等方面发挥了重要的调控作用。抗分化非编码RNA(anti-differentiation non-coding RNA,ANCR)是一种包含855个碱基的IncRNA。Kretz等发现ANCR的表达缺失可诱导表皮细胞中分化相关基因的大量表达,从而导致表皮细胞的分化。Zhu等发现ANCR在人成骨细胞分化时的表达显著下降,ANCR可通过募集增强子zeste homolog 2而抑制Runx2的表达,最终抑制人骨细胞的分化。Jia等发现,下调ANCR的表达可以促进牙髓组织干细胞向成骨细胞、脂肪细胞和神经细胞分化。基于以上的研究,可以认为ANCR具有抑制细胞分化的作用。那么ANCR是否也可以影响VSMCs成骨样分化的过程,目前尚不清楚。本研究利用β-GP干预小鼠VSMCs建立动脉钙化的细胞模型,构建ANCR过表达慢病毒载体并感染小鼠VSMCs,探讨ANCR过表达对VSMCs成骨样分化的抑制作用。
材料和方法
细胞与主要试剂
小鼠原代VSMCs购于江苏齐氏生物科技有限公司,转染增强剂Polybrene和Ehanced Infecction Solution均购于上海吉凯基因化学技术有限公司,β-GP、茜素红染料均购于美国Sigma公司,胎牛血清(fatal bovine serum,FBS)、DMEM/F12(1:1) 培养基均购于美国Gibco公司,青霉素-链霉素购于美国Genview公司,0.25%胰酶(含EDTA)购于美国Gibco公司,6孔板、细胞培养瓶均购于美国Labserve公司,All-in-One® First-Strand cDNA合成试剂盒和All-in-One® qPCR试剂盒均购于广州复能基因有限公司,小鼠抗小鼠Runt相关转录因子2(Runt related transcription factor 2,Runx2)、骨形成蛋白-2(bone morphology protein-2,BMP-2),核转录因子-kappa B(nuclear factor kappa B,NF-κB) p65抗体均购于美国Abcam公司,HRP标记的山羊抗兔、山羊抗小鼠二抗购于北京中杉金桥生物技术有限公司,小鼠β-actin、Runx2、BMP-2、ANCR引物(引物序列见表1)均购于生工生物工程(上海)股份有限公司,胞质及核蛋白提取试剂盒购于江苏碧云天生物技术有限公司,ECL化学发光液购于美国Millipore公司。
方法
动脉钙化细胞模型的建立:参照笔者以往的研究,应用10 mmol/L β-GP干预小鼠的VSMCs建立动脉钙化的细胞模型。小鼠原代VSMCs按5×105/孔接种到6孔板中,加入DMEM/F12(1:1) 完全培养基(含L-谷酰胺、10% FBS、100 U/mL的青霉素和100 μg/mL的链霉素)进行培养,给予10 mmol/L β-GP作为干预。分别在培养第3、6、9、12天收集细胞,qPCR检测Runx2和BMP-2的表达,以验证动脉钙化的细胞模型构建成功;同时qPCR检测ANCR的表达。
慢病毒感染:ANCR过表达慢病毒由上海吉凯基因化学技术有限公司构建,过程简要如下:ANCR过表达的质粒和病毒包装辅助质粒共转染293T细胞,收集细胞上清,收获病毒,离心浓缩,去除杂质,将病毒浓缩与纯化,得到浓度为5×108 TU/mL的慢病毒。得到慢病毒后,将小鼠VSMCs以5×105/孔接种到6孔板中,每孔加入2 mL的DMEM/F12(1:1) 完全培养基进行培养。参照预实验的结果,设定MOI值为100。VSMCs接种12 h后,以Eri.S+5 μg/mL Polybrene为感染条件进行感染,分为2组:阴性病毒组、阳性病毒组,每组设3个平行,48~72 h后观察荧光与细胞状态(图1)。qPCR检测阴性病毒组和阳性病毒组ANCR的表达情况,以证明感染有效。将实验分为4组,空白组、β-GP组、阴性病毒+β-GP组、阳性病毒+β-GP组,按照相应的组别将不同的细胞按照5×105/孔接种到6孔板中,DMEM/F12(1:1) 完全培养基培养,12 h后,空白组继续DMEM/F12(1:1) 完全培养基培养,β-GP组、阴性病毒+β-GP组、阳性病毒+β-GP组分别在DMEM/F12(1:1) 完全培养基的基础上给予10 mmol/L β-GP干预。干预96 h后收集细胞,qPCR检测Runx2和BMP-2 mRNA的表达,Western blot法检测Runx2、BMP-2和NF-κB p65蛋白的表达;干预21 d后,茜素红染色观察矿化结节的形成。

qPCR:使用Trizol(Life Technology,美国)提取细胞总RNA,取1 μg总RNA,利用All-in-One® First-Strand cDNA合成试剂盒,以25 μL的体系进行反转录,获得相应的cDNA。配制20 μL的实时定量PCR反应体系,每反应管加入cDNA模版2 μL、2×All-in-One® qPCR Mix 10 μL和ROX Reference Dye 0.2 μL,引物终浓度0.2 μmol/L。PCR循环反应条件:95 ℃预变性10 min,95 ℃ 10 s,60 ℃ 20 s,40个循环。Ct值为每个反应管内荧光信号到达设定域值所经历的循环数,用2-△△Ct法计算基因的相对表达水平。
Western blot法检测:待VSMCs干预完毕后,弃去6孔板中的完全培养基,室温下PBS冲洗两次,加入适当体积的胞质/核蛋白提取裂解液(含蛋白酶抑制剂),冰上静置20~30 min(中间间断混匀几次),收集细胞悬液,4 ℃,12 000 r/min,5 min,收集上清于EP管中,使用BCA蛋白浓度测定试剂盒测定蛋白样品的浓度,根据测定的样品的浓度,计算各样品中的总蛋白量,并向各样品中加入相应体积5×loading bufffer混匀,在100 ℃下变性5 min,统一各样品的浓度,-80 ℃保存备用。取20 μg变性蛋白,经10% SDS-PAGE电泳分离后,转印到0.2 μm的PVDF膜上;室温下5%的脱脂奶粉中封闭1 h,用PBS-T(含0.1%的TWEEN-20) 洗涤3次,加入稀释的小鼠抗小鼠Runx2(1:500)、小鼠抗小鼠BMP-2(1:500) 和兔抗小鼠NF-κB p65(1:400) 一抗,4 ℃孵育过夜;PBS-T洗涤3次,分别加入1:2 000稀释的HRP标记的山羊抗小鼠和山羊抗兔的二抗,室温摇床孵育1 h,PBS-T洗3次,PBS洗1次,加入ECL化学发光液(A液:B液=1:1),胶片曝光适当时间后显影、定影,观察条带。
茜素红染色:干预结束后PBS洗涤3遍,使用95%乙醇常温固定10 min,再次用PBS洗涤3遍,加入1%的茜素红,37 ℃温箱孵育1 h,PBS洗涤3遍,显微镜下观察矿化结节的形成,Image J软件进行分析。
统计学方法
实验数据用均数±标准差(x±s)表示,采用SPSS 20.0统计软件统计处理,组间比较应用单因素方差分析。以P<0.05为差异有统计学意义。
结果
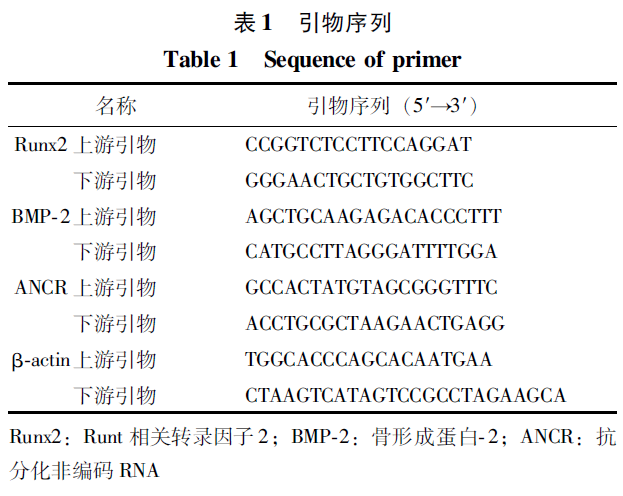
β-GP刺激VSMCs后对Runx2、BMP-2和ANCR mRNA表达的影响
qPCR结果显示,与空白组相比,在干预第3、6、9及12天,β-GP组Runx2和BMP-2 mRNA水平均显著升高,差异具有统计学意义(P<0.05);ANCR mRNA水平显著降低,差异具有统计学意义(P<0.05)(图2)。
ANCR过表达慢病毒感染VSMCs后对Runx2、BMP-2和ANCR mRNA表达的影响
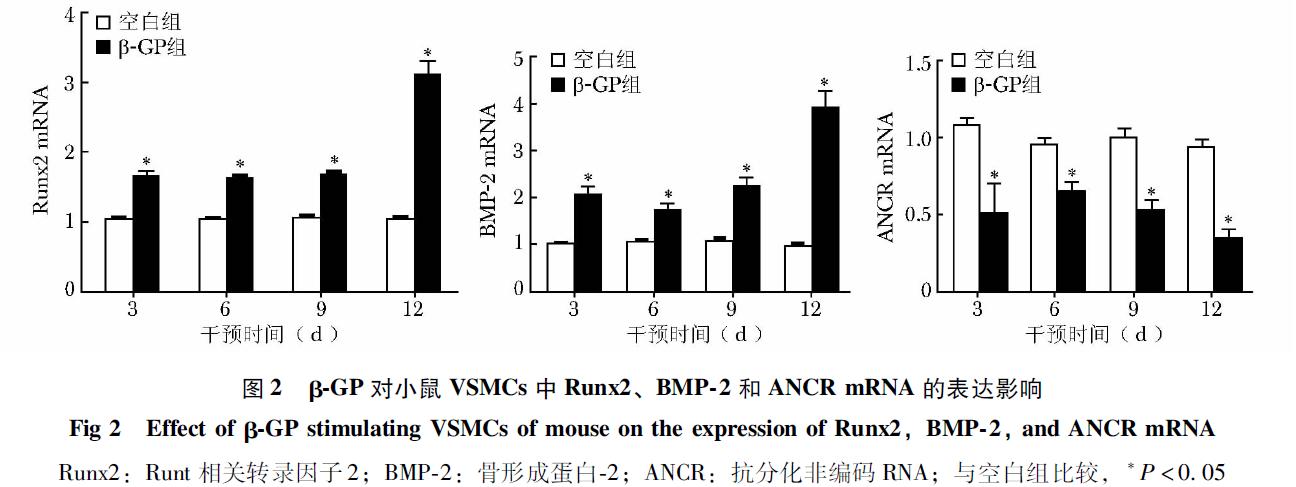
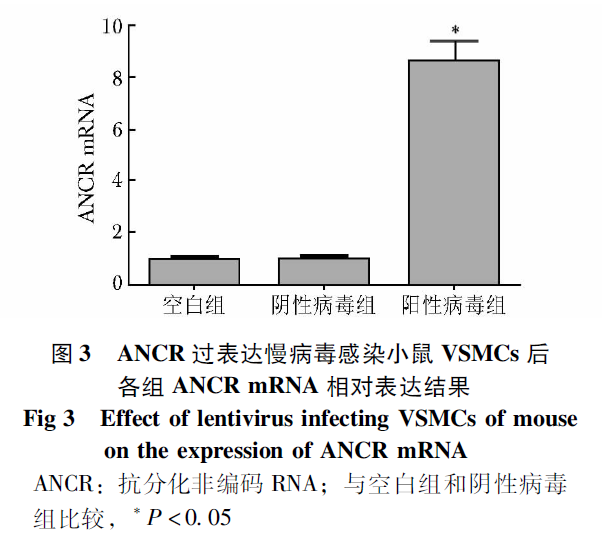
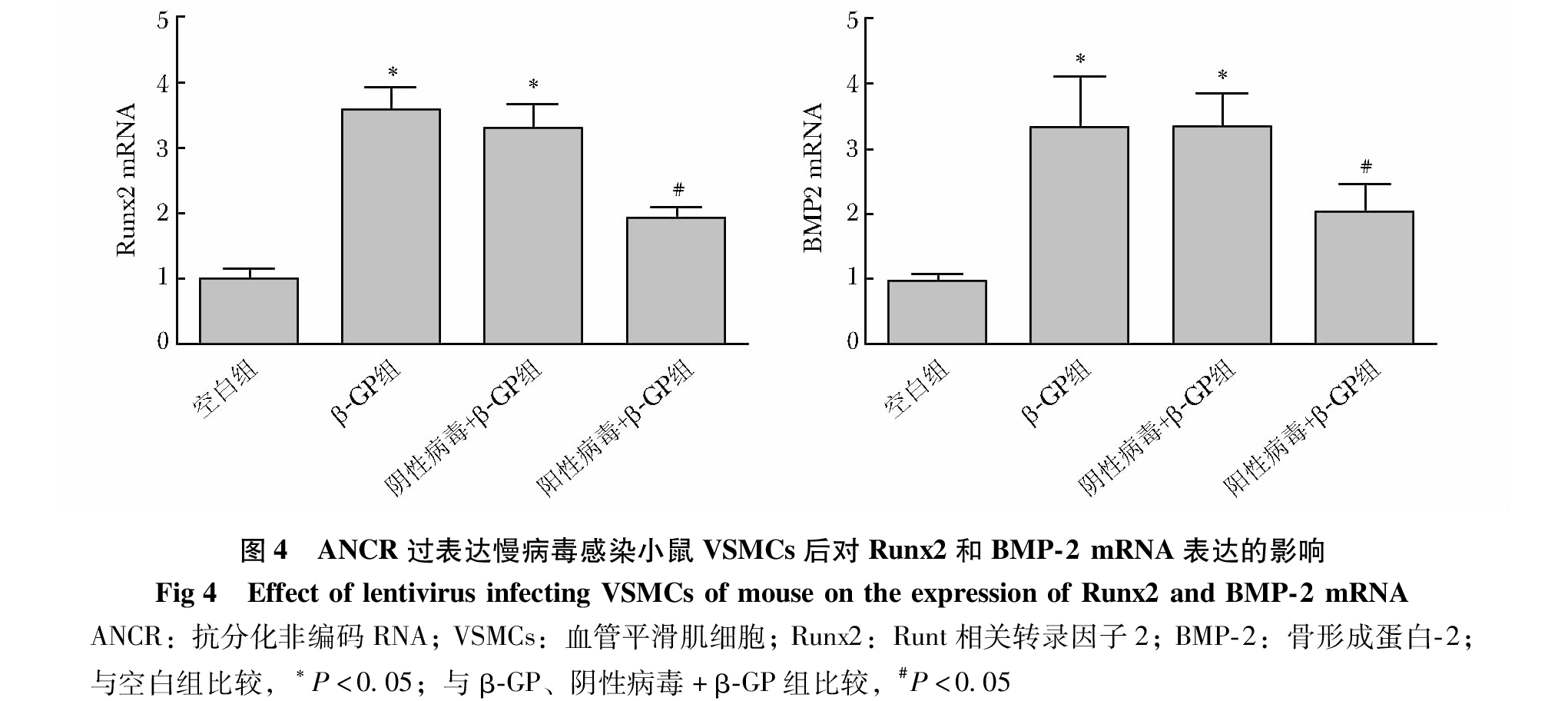
qPCR结果显示,阴性病毒组和空白组相比,ANCR的表达差异无统计学意义(P>0.05);与空白组和阴性病毒组相比,阳性病毒组ANCR的表达显著升高,差异有统计学意义(P<0.05),证明感染有效(图3)。与空白组相比,β-GP组、阴性病毒+β-GP组Runx2、BMP-2 mRNA显著升高,差异有统计学意义(P<0.05);与β-GP组相比,阴性病毒+β-GP组Runx2、BMP-2 mRNA水平差异无统计学意义(P>0.05);与β-GP组和阴性病毒+β-GP组相比,阳性病毒+β-GP组Runx2、BMP-2 mRNA水平显著降低,差异具有统计学意义(P<0.05)(图4)。
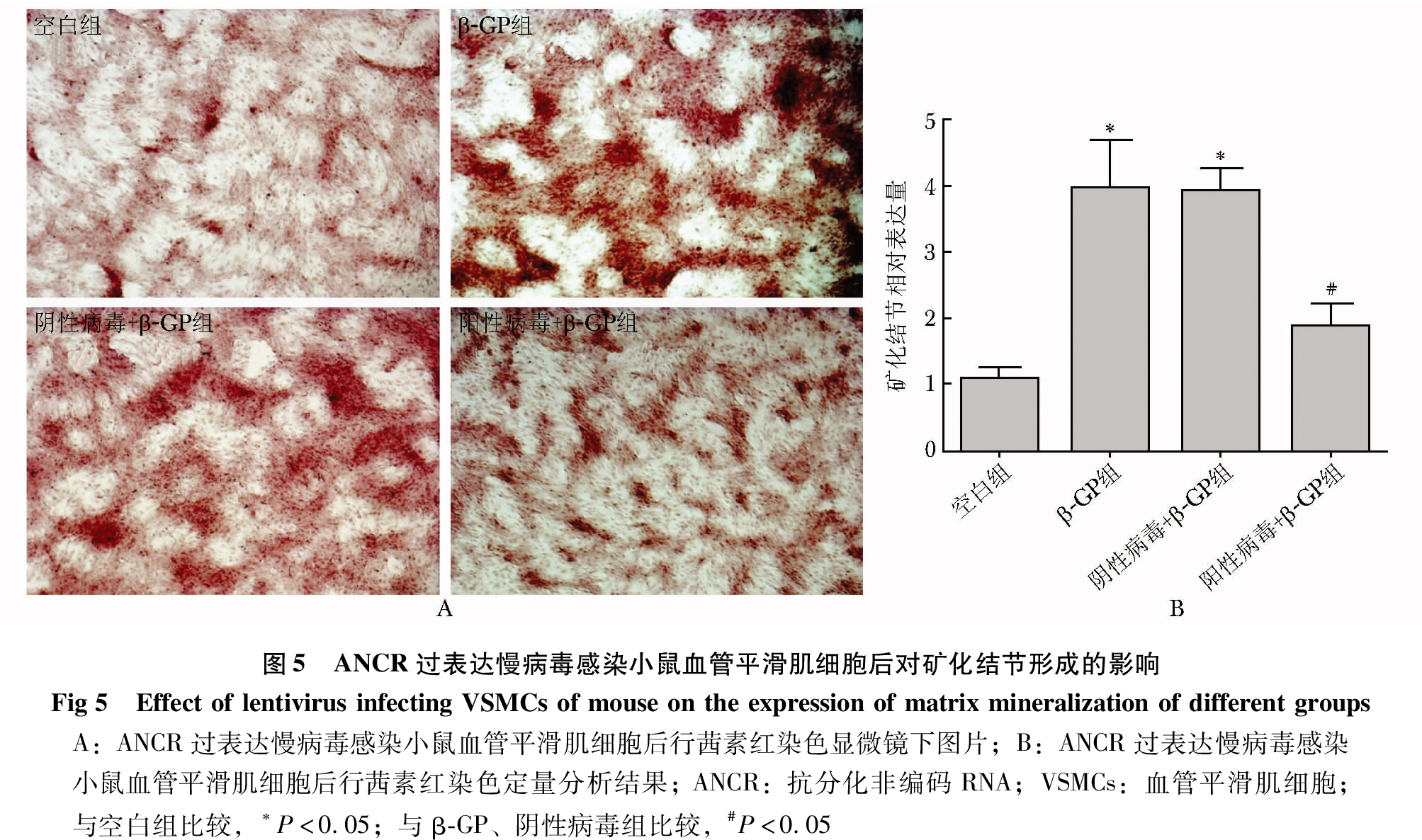
ANCR过表达慢病毒感染VSMCs后对矿化结节形成的影响
β-GP刺激VSMCs后,能形成明显的矿化结节。而ANCR过表达慢病毒感染VSMCs后,与空白组相比,β-GP组、阴性病毒+β-GP组有典型的钙化结节形成,差异具有统计学意义(P<0.05);与β-GP组、阴性病毒+β-GP组相比,阳性病毒+β-GP钙化结节的形成显著减少,差异具有统计学意义(P<0.05)(图5)。
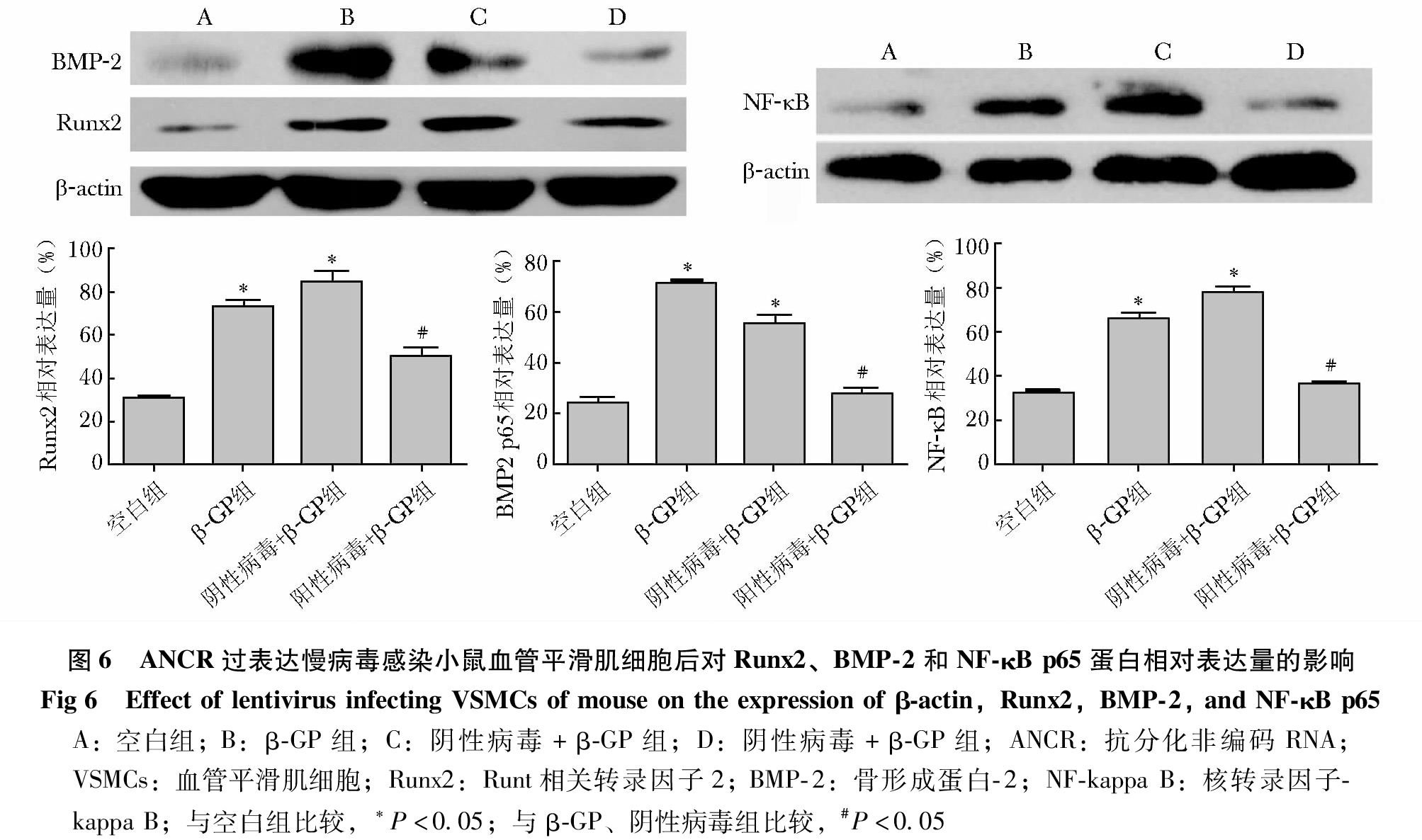
ANCR对VSMCs中NF-κB信号通路的影响
Western blot检测结果显示, 与空白组相比较,β-GP组和阴性病毒+β-GP组Runx2、BMP-2和NF-κB p65的蛋白水平表达显著增加,差异具有统计学意义(P<0.05);与β-GP组、阴性病毒+β-GP组相比,阳性病毒+β-GP组Runx2、BMP-2和NF-κB p65的蛋白水平表达显著降低,差异具有统计学意义(P<0.05)(图6)。
讨论
传统观点认为动脉钙化是“被动的”磷酸钙结晶沉积,是机体衰老的一种表现;而现在的研究表明,动脉钙化是类似于骨形成的一种主动调节过程,它受一些激素和细胞因子的调控。本研究首次证明lncRNA-ANCR在动脉钙化中发挥了重要的负性调控作用。
动脉钙化的发生是VSMCs进行成骨样分化的过程。在此过程中,VSMCs中Runx2、BMP-2、细胞核因子-κB受体活化因子配基(RANKL)、ALP、OCN等成骨细胞标志性分子的表达显著升高,并形成类似于成骨过程中的基质小泡,聚集钙离子,形成钙化中心,进而形成钙化结节。在本研究中,β-GP刺激后的小鼠VSMCs中Runx2、BMP-2的表达显著升高并伴有矿化结节的形成,证明动脉钙化的细胞模型建立成功。为了探讨ANCR是否参与了动脉钙化的发病过程,以β-GP刺激VSMCs,分别在3、6、9、12 d检测ANCR的表达,结果显示ANCR在上述不同时间点的表达较对照组均显著下降,提示ANCR与动脉钙化的发病有关。为了进一步明确ANCR在动脉钙化中的作用,构建了ANCR过表达慢病毒并感染了小鼠VSMCs,qPCR的结果显示,阳性病毒感染后的小鼠VSMCs中ANCR的表达是显著升高的,证明ANCR过表达慢病毒感染有效。进一步的qPCR和Western blot均证明,ANCR过表达可显著降低β-GP刺激的小鼠VSMCs中Runx2、BMP-2的表达,提示ANCR可抑制VSMCs的成骨样分化;进一步的茜素红染色证明了ANCR过表达可显著抑制β-GP刺激的小鼠VSMCs中矿化结节的形成。本研究结果证明,ANCR是动脉钙化发生过程中的关键性抑制因子。
NF-κB是Rel家族的转录因子,哺乳动物细胞中有5种NF-κBRel:RelA(P65)、RelB、C-Rel、P50、P52,它们通过形成同源或异源二聚体以启动不同的基因转录。NF-κB参与了包括炎症、脂质代谢、肿瘤、自身免疫等多种疾病的发生、发展过程。目前已经证实,NF-κB与动脉钙化的发生密切相关,抑制NF-κB信号通路可削弱动脉钙化的进程。最常见的NF-κB是由p50和p65组成的异源二聚体,在静息状态下NF-κB在胞质中存在,当受到刺激因子活化后NF-κB的p65亚基会发生核内转位,因此细胞核内NF-κB p65的表达水平是反映NF-κB信号通路活化水平的重要标志。NF-κB复合物进入核内,并参与增殖、凋亡和血管生成相关的基因的表达并激活其转录。本研究为了探讨ANCR调控VSMCs成骨样分化的可能机制,检测了ANCR过表达的VSMCs核内NF-κB p65的表达。结果显示,ANCR过表达可以显著减少β-GP刺激后的小鼠VSMCs中NF-κB的活化水平。本研究结果显示:ANCR过表达的小鼠VSMCs中NF-κB的活化水平下降伴随着Runx2和BMP-2表达的下降,同时ANCR过表达的小鼠VSMCs中矿化结节显著减少。本研究结果提示:ANCR通过抑制NF-κB的活化水平而降低小鼠VSMCs中Runx2和BMP-2的表达并最终抑制小鼠VSMCs的成骨样分化。Feng等研究发现,TNF-α可以通过NF-κB信号通路上调Runx2和BMP-2的表达而促进人牙髓干细胞的成骨样分化。本研究结果与该研究发现一致,即NF-κB调控Runx2和BMP-2的表达是成骨样分化这一进程中的重要事件。然而,Hou等利用大鼠VSMCs建立动脉钙化细胞模型,发现姜黄素抑制VSMCs成骨样分化的作用与NF-κB信号通路无关。笔者认为产生这一差异的原因有两个:(1) 不同种属间成骨样分化调控的具体机制可能不同;(2) 在小鼠VSMCs成骨样分化的过程中,Runx2和BMP-2可能受多个信号通路的调控,ANCR过表达可通过抑制NF-κB的活化而下调Runx2和BMP-2的表达。其具体的分子机制尚需进一步研究。
综上所述,本研究成功构建了动脉钙化细胞模型并证明ANCR可能是动脉钙化中的关键性负性调节因子;ANCR可能通过削弱NF-κB信号通路抑制β-GP刺激的小鼠VSMCs成骨样分化,但是ANCR抑制NF-κB的具体机制仍不明确。ANCR能否作为治疗动脉钙化的新靶点,尚需进一步的研究。