遗传性骨病及二代测序技术应用进展
来源:CSOBMR 发布日期:2017-07-06 00:00:00浏览:13757次
作者:章振林 张增 魏哲
单位:上海交通大学附属第六人民医院骨质疏松和骨病专科 骨代谢病和遗传研究室
摘要:遗传性骨病虽然罕见,但致畸率、致残率高,严重影响青少年身心健康,需高度关注并尽可能开展恰当的诊疗。遗传性骨病确诊依赖于致病基因突变检测,及早确诊有助于治疗方案的选择和开展遗传咨询、干预等。本文对遗传性骨病背景和分类、致病基因鉴定方法,以及近年推出的二代测序技术在遗传性骨病中应用进展做一阐述,希望对临床医师开展骨病研究有所裨益。
关键词:遗传性骨病;分类;致病基因;二代测序
从遗传学角度,可以将所有疾病粗略地分为两类:多基因病和单基因病。单基因遗传病即由单个基因突变导致;多基因遗传病即由遗传因素与环境因素共同作用而发病。
单基因病的特点
(1) 简单:是指发病模式简单,环境因素作用小,致病基因可以是常染色体、X或Y染色体,发病模式为隐性或显性;(2) 严重:往往由严重影响蛋白功能的基因突变所致;(3) 罕见:这些严重突变往往被自然选择淘汰。
很多单基因骨病属于罕见病范畴,世界卫生组织(World Health Organization, WHO)将罕见病定义为患病人数占总人口的0.65/1 000~1.0/1 000的疾病或表型,我国于2010年5月在上海达成了专家共识,将中国罕见病定义为患病率<1/50万,或新生儿发病率<1/1万。
单基因骨病特征和研究意义
单基因骨病的特点和现状:严重骨骼生长发育障碍,可能致畸、致残,甚至致死;早期诊断非常重要,尤其是对判断预后、治疗及遗传咨询都具有重要作用;由于罕见,临床医师认识不足,诊断可能极为困难,多要依赖基因突变检测才能确诊;很多类型单基因骨病,致病基因不明确或者致病分子机制尚未阐明,缺少有效的治疗药物,多数仅采用对症处理。
开展单基因骨病研究的意义:明确诊断,阐明疾病的分子机制,为临床上判断预后、治疗和遗传干预等提供重要依据;明确致病基因,通过了解致病分子机制,有助研发“孤儿药”;同时,加深对常见病分子机制的理解,可能发现治疗常见疾病的药物靶点,如基于SOST、RANK、CTSK等基因突变所致罕见骨病病例的研究和发现,开发了治疗骨质疏松的新型药物。
单基因骨病分类
按照最新版的国际骨骼发育不良学会(International Skeletal Dysplasia Society,ISDS)对单基因骨病的命名与分类(2015年版),共分40大组,456种疾病,主要依据分子、生物化学及影像学标准进行分类。根据最近几次修订版本,命名与分类有变化,特点是所包含的疾病范围越来越广;分类越来越强调致病基因或通路;各类型间的界限越来越模糊。由此引出一些问题,纯粹按照临床表现和影像学特征,很难明确各个类型,尤其对于骨骼发育不良类疾病,影像学表现很多较相似,明确区分有些病例还得靠基因诊断。骨病的分类如下。
拥有一个共同的致病基因或者通路进行分类,有1~8组疾病
与FGFR3相关的软骨发育不全(FGFR3 chondrodysplasia group);2型胶原类疾病(type 2 collagen group and similar disorders);11型胶原类疾病(type 11 collagen group);硫酸盐化疾病(sulphation disorders group);基底膜聚糖类(perlecan group);软骨聚蛋白聚糖类(aggrecan group);细丝蛋白类及其相关疾病(filamin group and related disorders);阳离子瞬时电势通道亚家族V成员4受体类(TRPV4 group)。
累及特定骨结构或特定的节段,有第9~17组疾病
短肋发育不良症(short-ribs dysplasias);多发性骨骺发育不良症(multiple epiphyseal dysplasias);骨干骺发育不良症(metaphyseal dysplasias);脊柱干骺发育不良症(spondylometaphyseal dysplasias);脊柱-骨干-骨骺发育不良症[spondylo-epi-(meta)-physeal dysplasias];重症脊柱干骺发育不良症(severe spondylodysplastic dysplasias);肢端发育不良症(acromelic dysplasias);肢端肢中发育不良症(acromesomelic dysplasias);肢中发育不良症(mesomelic and rhizo-mesomelic dysplasias)。
骨骼弯曲、骨骼纤细或者多发性关节脱位,有第18~20组疾病
颌骨-肢骨发育不良症(bent bones dysplasias);骨细长发育不良症(slender bone dysplasias);发育不良伴多关节脱位(dysplasias with multiple joint dislocations)。
矿化异常,有第21~26组疾病
软骨点状发育不良症(chondrodysplasia punctata); 新生儿硬化性骨发育不良症(neonatal osteosclerotic dysplasias);骨密度增高类疾病(increased bone density group);骨密度增高类疾病干骺端和/或骨干受累(increased bone density group with metaphyseal and/or diaphyseal involvement);成骨不全和骨密度降低类疾病(osteogenesis imperfecta and decreased bone density group);异常矿化类疾病(abnormal mineralization group)。
骨溶解及其他异常,有第27~31组疾病
累及骨骼的溶酶体贮积症[lysosomal storage diseases with skeletal involvement(dysostosis multiplex group)];骨溶解类(osteolysis group);异常骨形成类疾病(disorganized development of skeletal components group);累及骨骼的过度生长综合征[overgrowth (tall stature) syndromes with skeletal involvement];遗传性炎性反应及类风湿样骨关节病(genetic inflammatory/rheumatoid-like osteoarthropathies)
骨骼发育不全,有第32~40组疾病
锁骨-颅骨发育不良症(cleidocranial dysplasia);颅缝骨结合综合征(craniosynostosis syndromes);颅面骨受累为主的骨发育不全症(dysostoses with predominant craniofacial involvement);脊柱受累为主的骨发育不全症,伴或不伴肋骨受累(dysostoses with predominant vertebral with and without costal involvement);髌骨发育不良(patellar dysostoses);短指畸形(brachydactylies);肢体发育不全-短缺畸形类疾病(limb hypoplasia-reduction defects group);多指-并指-拇指三指节畸形类疾病(polydactyly-syndactyly-triphalangism group);骨关节和骨结合发育缺陷(defects in joint formation and synostoses)。
以上是按照2015年新版分类的疾病,在2010版分类共有456种单基因骨病,其中311种致病基因已知。尤其是二代测序(next generation sequencing)技术应用于新致病基因的鉴定后,鉴定速度越来越快;疾病新的亚型、甚至新的疾病不断涌现。国内研究者早在2001年对短指症(brachydactyly,type A1) 已鉴定到IHH基因,2009年,研究发现了FGF9基因突变导致多发性骨性联结综合征(multiple synostoses syndrome 3),本研究组于2012年利用二代测序技术发现SLCO2A1是原发性肥大性骨关节病的致病基因。
致病基因鉴定方法
绝大多数遗传性骨病是已知基因突变导致的,另外少数病例是未知基因导致。前者致病基因相对比较容易,根据文献报告的遗传性疾病,找出可能的致病基因,利用一代(Sanger)DNA测序法,鉴定突变位点,费用较低,时间短,但是需要临床医师具有较丰富的经验,临床诊断比较明确,才能针对性开展致病基因突变筛查,北京协和医院内分泌科和上海交通大学附属第六人民医院骨代谢病和遗传研究室近年鉴定了多个已知基因突变家系,有些是国内首次报道。但是,由于一代测序技术作用局限,尤其是对于未知基因的鉴定,尽管有连锁定位等技术支持,也可能无法准确鉴定,家系连锁分析结合一代测序的优势是可能鉴定到新致病基因或者已知基因的突变位点,但是缺点在于:(1) 需要大家系,多人发病,收集到所有家系中患者和健康人是关键;(2) 多个家系一起分析,可以增加阳性结果,但是表型要一致,需要有一定水平临床专家的判断,而家系间的异质性将严重影响结果。
一代DNA测序技术所存在最大问题是对于未知致病基因的鉴定,加拿大罕见疾病基因发现联盟[Finding of Rare Disease Gene(FORGE) Canada consortium]提出的对未知致病基因的鉴定策略如表1述。

基于中国的国情,当前发病大家系很少,很多病例是小家系或者是散发病例,如何解决后者的致病基因确实是个挑战,全基因组(whole genome sequencing)或全外显子组(whole exome sequencing)测序是利用序列捕获技术,将探针能覆盖到的全基因组或全外显子区域,DNA捕捉并富集后再进行高通量测序的基因组分析方法。目前全外显子组测序费用要明显低于全基因组测序,而且全外显子组只占人类基因组的~1%(约30 Mb),约85%的人类致病突变都位于这1%的蛋白质编码序列上,因此,全外显子组测序能鉴定到很大部分的致病突变,因此被广泛应用。全外显子组测序的优势在于:大多数疾病相关的变异都位于外显子区域;高深度测序,可发现常见变异和频率低于1%的罕见变异;有效降低费用、周期和工作量。其应用领域:孟德尔疾病-疾病分子诊断,复杂疾病,癌症-发现低频变异。
2009年华盛顿大学Ng等发表了二代测序技术检测了12人全外显子组,2010年该团队对米勒综合征通过全外显子组测序发现DHODH是致病基因,该研究仅仅利用了一个小家系和2例散发病例,足以说明全外显子组测序技术对于鉴定小家系或者散发病例的致病基因具有独特优势。此后,该技术不仅可用于孟德尔疾病,也可用于一些复杂疾病包括癌症等,鉴定到突变有些是体细胞突变,这些发现大大推进了对肿瘤、癌症等发病机制的认识。而目前二代测序更常用于孟德尔遗传病的数据分析,发现新致病基因,可以使用家系样本、多个散发样本、多个家系样本或者单个样本的测序,但是数据分析不但要依赖遗传模式,而且多个家系或者多个散发样本要寻找共同的致病基因。
对于核苷酸变异分析流程一般遵循如下步骤:外显子测序-编码突变-去除常见突变-样本中共有突变-确定疾病突变。外显子测序的数据分析查找致病基因突变,首先依赖遗传模式:常染色体显性、隐性遗传及X显性、X隐性遗传,所以提供准确的家系遗传模式非常重要,尽可能采集到患者和家系成员的临床资料;其次,确定是杂合子、纯合子或复合杂合子发病;后续对于可能的致病基因突变应该在其他样本中验证、生物信息学分析、细胞功能研究或模式动物研究等。
二代测序技术在遗传性骨病中的应用
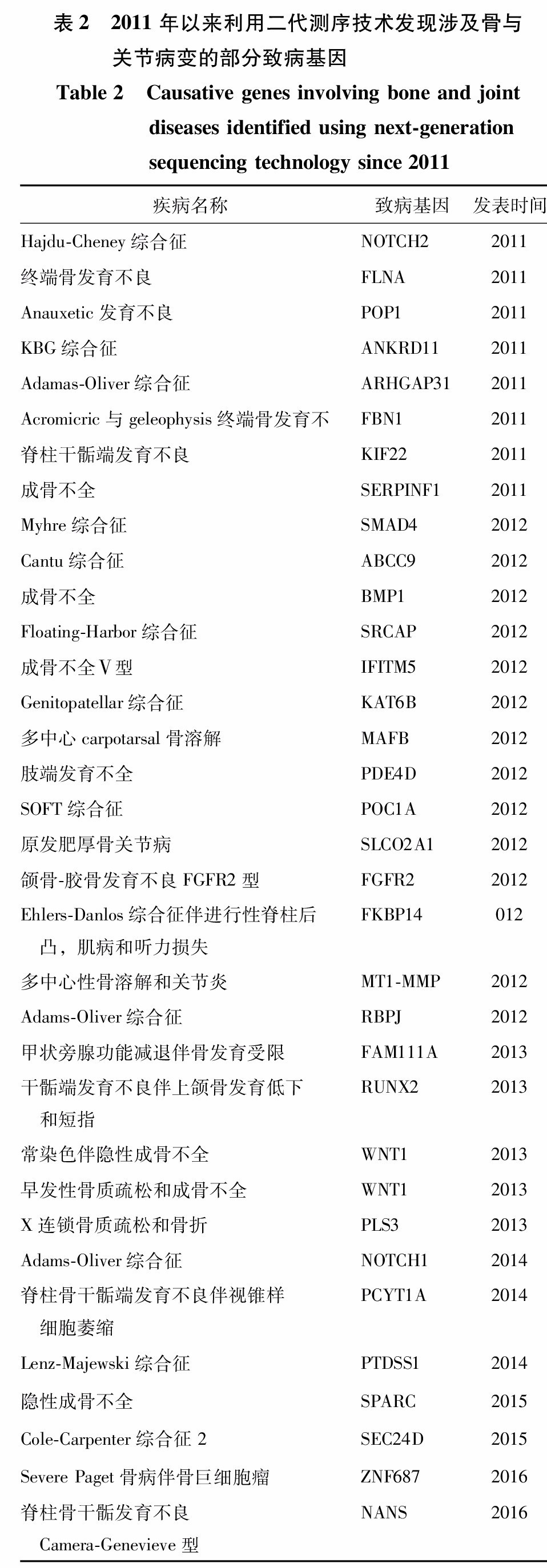
二代测序技术的广泛应用,使遗传性骨病很多致病基因被发现,此外由于涉及骨与关节遗传病新致病基因发现较多,限于篇幅,表2仅列出部分重要致病基因。根据文献检索结果,2011年以来近150个涉及骨或关节的骨病或综合征新致病基因被发现,基本都发表在顶级杂志如《新英格兰医学杂志》《自然遗传学》和《美国人类遗传学杂志》等,这些新致病基因的成功鉴定,不但大大促进了本领域的发展,而且加快了后续研发这些单基因骨病或常见骨病治疗药物的进程。
小结
对于遗传性骨病的临床研究,笔者体会如下:(1) 原始创新是关键;(2) 注重病例或家系资源收集是研究的保障;(3) 密切关注和利用新技术开展临床型研究是策略。
中国是人口大国,遗传性骨病基数庞大,很多骨病为散发,需要临床医师尽可能收集家系样本,建立骨与关节等影像资料,开展致病突变检测,以大大提高临床确诊率,同时开展产前分子诊断等干预,才能切实降低遗传性骨病的发病率;对于诊断不能明确或者未知致病基因的病例,可以利用二代测序技术,发现新致病基因,阐明分子机制,不但对单基因骨病的诊治和干预具有重要价值,而且对研发骨质疏松类常见病的药物具有重大意义。